Stratégie de recherche axée sur le patient du Canada
Améliorer les résultats en santé par des soins basés sur des données scientifiques
Août 2011
Table des matières
- Préface
- Résumé : Stratégie de recherche axée sur le patient du Canada
- Introduction
- Le paysage canadien
- 2.1 Les fondations du Canada
- 2.2 Deux fossés entre la recherche et la pratique
- 2.3 Principaux facteurs favorables
- 2.3.1 Décentralisation du pouvoir et de l'établissement des priorités
- 2.3.2 Lacunes dans la formation et le soutien professionnel des ressources humaines
- 2.3.3 Contraintes financières
- 2.3.4 Absence de données et de plateformes technologiques uniformisées
- 2.3.5 Retards dans l'approbation des études cliniques multicentriques à grande échelle
- 2.3.6 Lacunes dans l'élaboration, la diffusion et la mise en pratique des lignes directrices
- 2.3.7 Rôle limité des patients dans la recherche axée sur le patient
- Le paysage international
- La stratégie
- 4.1 Vision
- 4.2 Objectifs
- 4.3 Principes
- 4.4 Combler les fossés entre la recherche et la pratique
- 4.4.1 Établir un leadership commun
- 4.4.2 Constituer une réserve de talents
- 4.4.3 Améliorer la conduite, le financement et l'efficacité des essais cliniques multicentriques
- 4.4.4 Se concentrer sur les réseaux de recherche axée sur le patient
- 4.4.5 Établir des unités de soutien
- 4.4.6 Améliorer la formulation, la diffusion et la mise en pratique des lignes directrices
- Conclusion
- Bibliographie
- Annexe 1 : Membre du Conseil consultatif du président – Stratégie de recherche axée sur le patient
Préface
Le présent document expose une vision et une stratégie visant à obtenir de meilleurs résultats en santé et à offrir de meilleurs soins aux patients grâce à la recherche. Il est fondé sur le principe selon lequel une meilleure mise en pratique des résultats de la recherche aura des effets positifs sur la santé des Canadiens et l'efficacité du système de santé.
Ce document a été rédigé sous la direction des Instituts de recherche en santé du Canada (IRSC), le principal organisme de recherche en santé au Canada. La recherche axée sur le patient est la pierre angulaire du plan stratégique 2009-2010 des IRSC (L'innovation au service de la santé), qui expose les orientations stratégiques de l'organisme pour les cinq prochaines années.
Les IRSC ont été guidés dans ce travail par le conseil consultatif du président, composé de douze membres canadiens et étrangers représentant une grande diversité d'expériences, de compétences et de perspectives. Le conseil consultatif s'est réuni entre janvier 2009 et août 2010. Son travail a été dirigé avec brio par le Dr Paul Hébert, avec l'aide du Dr Joe Pater, qui méritent tous les deux d'immenses remerciements. Le conseil a aussi énormément profité des conseils et de l'aide des 13 directeurs scientifiques et des membres du personnel des IRSC à divers niveaux de l'organisme.
Entre février et juin 2010, une série de consultations sur une version antérieure du présent document a été organisée. Des entretiens en personne ont été tenus auprès d'organismes universitaires de soins de santé, d'industries des sciences de la vie, d'organismes bénévoles en matière de santé, d'associations de professionnels de la santé et d'autres intervenants concernés. Des rencontres ont aussi eu lieu avec des fonctionnaires de Santé Canada, du ministère des Finances, du Bureau du Conseil privé, de l'Agence de la santé publique du Canada et d'Industrie Canada, ainsi qu'avec des représentants de gouvernements provinciaux et territoriaux, et d'organismes provinciaux de financement de la recherche en santé. Enfin, Harris/Décima a été chargée de l'hébergement et de l'analyse d'un sondage en ligne, dont la vaste majorité des 288 répondants étaient des chercheurs du secteur de la santé et 10 %, des membres du public.
Les résultats de ces consultations ont fait l'objet de discussions à la dernière réunion du conseil consultatif, le 17 août 2010. Dans l'ensemble, on a convenu de la nécessité d'une stratégie pour le Canada et des éléments proposés. Nombre d'améliorations ont été suggérées et quantité de lacunes ont été cernées. En particulier, on a souligné le besoin d'élaborer une stratégie reflétant mieux la perspective du patient, de reconnaître les différences et les besoins régionaux et de s'y adapter, ainsi que de tenir compte de façon plus explicite de la variété des disciplines de la santé et des contextes cliniques couverts par la stratégie.
Le présent document final du conseil consultatif tient compte de l'ensemble des contributions susmentionnées et d'autres avis exprimés par les membres du conseil consultatif et les directeurs scientifiques des IRSC. Il constituera dorénavant le texte fondateur d'un comité directeur national chargé de superviser l'élaboration et la mise en oeuvre d'un plan d'action. On espère qu'il favorisera l'engagement des groupes d'intervenants et des partenaires, et qu'il stimulera les changements nécessaires à la transformation du paysage des soins de santé par la recherche et l'innovation, au profit de tous les Canadiens.
Résumé : Stratégie de recherche axée sur le patient du Canada
La recherche axée sur le patient, pilier des soins de santé basés sur des données scientifiques, désigne un continuum scientifique allant des recherches initiales sur des humains jusqu'aux études comparatives sur l'efficacité et les résultats, et son intégration au système de santé et aux pratiques cliniques.
La recherche axée sur le patient a pour but de mieux garantir l'accessibilité des nouvelles méthodes diagnostiques et thérapeutiques pour les patients sur les lieux d'intervention, et d'aider les provinces et les territoires à offrir des services de santé de haute qualité de façon efficace et à moindre coût. Elle fait en sorte que le patient reçoive les bons soins au bon moment, pour de meilleurs résultats en santé.
La vision de la Stratégie de recherche axée sur le patient est d'améliorer de façon démontrable les résultats cliniques et l'expérience des patients quant aux soins de santé, par l'intégration de données probantes à tous les niveaux du système.
Les objectifs de cette vision sont les suivants :
- créer un processus pancanadien concerté pour la détermination, l'établissement et la mise en oeuvre des priorités de la recherche axée sur le patient;
- établir une infrastructure intégrée de recherche clinique de pointe pour le Canada, s'harmonisant avec tout le continuum de la recherche axée sur le patient;
- renforcer la capacité du Canada d'attirer, de former et d'encadrer des professionnels de la santé et des chercheurs en santé, et créer des cheminements professionnels viables en recherche axée sur le patient;
- rendre le cadre organisationnel, réglementaire et financier plus favorable aux études cliniques au Canada et faire participer davantage les patients et les cliniciens à ces études;
- améliorer le processus de repérage des pratiques exemplaires, accélérer leur développement et leur adaptation sous forme de recommandations cliniques et soutenir leur adoption par les cliniciens, les soignants et les patients.
Le problème
Le Canada possède déjà des bases solides dans la poursuite de l'excellence en recherche axée sur le patient, notamment : une communauté de recherche biomédicale; des chercheurs cliniques présents dans tout le pays et dans toutes les disciplines; des chercheurs de réputation internationale dans les domaines de la recherche clinique et des services de santé; et une position de leader mondial en examens systématiques. De vastes bases de données administratives et cliniques nationales et provinciales permettent aux chercheurs d'évaluer les tendances actuelles dans le domaine des soins de santé, de faire d'importantes corrélations entre des interventions et des résultats, et d'observer les variations dans les pratiques. Le Canada possède aussi une riche expérience dans la création de réseaux de recherche clinique multidisciplinaires.
Malgré ces atouts indéniables, le continuum de la recherche à la pratique traverse un double passage à vide au Canada, souvent appelé les deux fossés du paysage de la santé. Le premier fossé représente la diminution de la capacité d'application des résultats de la recherche biomédicale fondamentale sous forme d'avantages pour le patient, et de la capacité de commercialiser les découvertes en santé. Cela influe négativement sur la recherche et les connaissances cliniques du Canada et sur sa compétitivité internationale. Le deuxième fossé consiste en la capacité limitée de synthétiser, de diffuser et d'intégrer les résultats de la recherche de façon plus systématique aux pratiques cliniques et au processus décisionnel en santé. Le Canada doit combler ces fossés s'il veut que la science contribue à l'amélioration des résultats en santé et que son système de santé demeure viable.
Ces fossés dans le continuum recherche-pratique s'expliquent par un certain nombre de facteurs, notamment :
- le manque de chercheurs cliniques, de spécialistes en méthodologie comme des biostatisticiens, et de spécialistes en épidémiologie clinique, en économie de la santé et dans d'autres domaines importants;
- la difficulté de coordonner de vastes études multicentriques en raison de la multitude d'évaluations éthiques imposées par les différents établissements et de l'absence de contrat modèle;
- le sous-financement de la recherche axée sur le patient en comparaison de nombreux autres pays;
- la structure fédérale décentralisée qui complique la coordination de la recherche;
- les lacunes dans la formulation et la diffusion des recommandations et dans leur mise en pratique, malgré leur valeur reconnue;
- la participation limitée des patients dans la recherche axée sur le patient.
La solution proposée
Il est essentiel que la stratégie soit guidée et dirigée par tous les ordres de gouvernement pour que celle-ci atteigne ses objectifs et que le changement se matérialise. Comme premier pas, on propose l'établissement d'un comité directeur national composé de représentants des principaux intervenants des secteurs public (fédéral et provincial) et privé. Ce comité aura pour rôle de mettre en oeuvre la stratégie et de veiller à ce que tous s'y engagent et l'adoptent. Dans son travail, le comité directeur sera guidé par les sept principes de la stratégie : collaboration, réceptivité, excellence, inclusivité, innovation, responsabilisation, et transparence. Les patients auront un rôle clé à jouer pour assurer la pertinence des priorités de recherche et l'efficacité du transfert des connaissances.
Pour atteindre les objectifs de la stratégie et commencer à combler les vides dans le continuum recherche-pratique, certaines initiatives sont proposées dans cinq grands champs d'action.
1. Constituer une réserve de talents
Pour renforcer la capacité de recherche axée sur le patient, il est nécessaire de développer et de promouvoir les compétences pertinentes. Pour ce faire, le Canada doit refondre ses programmes de bourses de formation et d'appui salarial pour tous les types de chercheurs cliniques. Les bourses seront conçues en fonction de diverses stratégies de pratique et de rémunération et tiendront compte de l'engagement de l'établissement du candidat et du contexte de son programme. L'engagement des établissements couvrira des dispositions en matière d'aide salariale, de recrutement de membres d'équipe, de développement de programmes et d'infrastructure.
Le Canada doit aussi augmenter son contingent de spécialistes en méthodologie au service de la recherche axée sur le patient et de professionnels de la santé, surtout ceux qui détiennent un diplôme d'études supérieures et qui sont formés à l'utilisation des méthodes de recherche fondamentales. Cela nécessitera que les universités de tout le pays soutiennent davantage les programmes de maîtrise et de doctorat dans des domaines comme l'épidémiologie et la biostatistique, l'économie de la santé et d'autres sciences sociales liées à la santé. Cela implique aussi la mise sur pied de programmes de formation normalisés destinées aux coordonnateurs et aux gestionnaires de projets de recherche, ainsi qu'aux autres membres du personnel de soutien.
2. Améliorer la réalisation, le financement et l'efficacité des essais cliniques multicentriques
La conjoncture actuelle du Canada complique la conception, la mise en oeuvre et le financement d'essais cliniques multicentriques, et cela nuit à sa compétitivité. Pour devenir plus concurrentiel en matière d'essais cliniques, le Canada doit surmonter un certain nombre d'obstacles reconnus comme le financement inadéquat des essais, l'absence de modèle de contrat uniformisé entre les chercheurs et l'industrie pour faciliter la recherche, et l'absence de mécanismes d'approbation éthique harmonisés pour accélérer l'examen éthique des essais multicentriques. Il est particulièrement important d'augmenter considérablement les fonds offerts pour les études bien conçues sur des questions d'importance pour les patients et les soins aux patients.
3. Se concentrer sur les réseaux de recherche axée sur le patient
La coordination de la recherche axée sur le patient doit être améliorée. Pour profiter de l'expérience du Canada dans les réseaux multidisciplinaires axés sur des solutions pratiques et pour surmonter les obstacles actuels à la viabilité, à la collaboration et au soutien méthodologique, la stratégie doit soutenir des réseaux thématiques de recherche axée sur le patient.
Ces réseaux de recherche clinique établiront des priorités de recherche et des protocoles cliniques, contribueront à la surveillance scientifique des programmes de recherche, soutiendront les chercheurs par diverses activités d'enseignement ou de mentorat et favoriseront la recherche interdisciplinaire. Certains de ces réseaux pourraient servir de plateformes nationales pour des essais cliniques dans des domaines particuliers. Chaque plateforme comporterait l'établissement et l'entretien de bases de données et de dépôts de données pertinentes (comme des biobanques) et la centralisation des opérations de randomisation, de l'aide au recrutement de patients ainsi que des capacités et des installations de collecte et d'analyse de données pour soutenir les demandes présentées aux conseils d'éthique de la recherche.
4. Créer des unités de soutien et les pourvoir en ressources
En réponse à la nécessité d'augmenter les capacités canadiennes en recherche axée sur le patient et de fournir une aide méthodologique aux chercheurs déjà engagés ou désireux de s'engager dans ce genre de recherche, des centres de services spécialisés en recherche, appelés unités de soutien à la recherche axée sur le patient, seront créés. Ces unités de soutien seront des centres multidisciplinaires regroupant des spécialistes en méthodologie (épidémiologistes cliniques, biostatisticiens, économistes de la santé, spécialistes en sciences sociales et en essais cliniques, etc.) ainsi que du personnel de soutien à la recherche chargé d'aider les chercheurs à concevoir des études pertinentes, à faire des analyses biostatistiques, à gérer des données et des biobanques, à acquérir des compétences en gestion de projet et à répondre à toutes les normes applicables.
5. Améliorer la formulation, la diffusion et la mise en pratique des lignes directrices
La stratégie propose enfin d'investir les ressources nécessaires dans une approche concertée visant à améliorer la qualité des soins et les résultats en santé par la mise en application de lignes directrices et de pratiques cliniques exemplaires. La stratégie vise à faciliter la formulation, la diffusion et la mise en pratique de lignes directrices par le développement des capacités de synthèse des connaissances, la formation adéquate des responsables des lignes directrices, l'étude approfondie des obstacles à la mise en pratique et le soutien de la mise en oeuvre et de l'évaluation des lignes directrices.
Il est important que les patients participent à tous les aspects de la stratégie pour que celle-ci produise les résultats escomptés.
Conclusion
En 2025, le Canada aura amélioré de façon manifeste ses résultats en matière de santé et l'expérience thérapeutique des patients par l'intégration des preuves scientifiques à tous les niveaux du système de santé. Il s'agit de la vision qui oriente l'élaboration de la Stratégie de recherche axée sur le patient du Canada. Elle profitera à toutes les personnes concernées : aux patients, par l'obtention des bons soins, au bon endroit et au bon moment; aux gouvernements et aux administrateurs de la santé provinciaux, par la création de systèmes de santé efficaces et économiques répondant aux besoins des patients; et au gouvernement du Canada, par l'atteinte d'objectifs clés de la stratégie des sciences et de la technologie, notamment la possibilité de travailler avec des partenaires pour stimuler la commercialisation de la recherche.
1.0 Introduction
1.1 Qu'est-ce que la recherche axée sur le patient?
La recherche axée sur le patient est le pilier des soins de santé basés sur des preuves scientifiques, un concept relativement récent développé surtout au Canada1. Dans une récente enquête menée par le British Medical Journal auprès de ses lecteurs, la médecine factuelle a été citée parmi les dix plus grands progrès médicaux de tous les temps2.
Les professionnels et les responsables des politiques du domaine de la santé ont besoin de données scientifiques pour offrir efficacement et à bon coût des soins appropriés de haute qualité. Cela nécessite le transfert rapide et efficace des innovations scientifiques du laboratoire au chevet des patients, ainsi que l'évaluation et la synthèse des connaissances existantes et leur application rapide au milieu clinique. Signalons, à titre d'exemple, l'utilisation d'une simple liste de contrôle produite par l'Organisation mondiale de la santé. Cette liste de 19 points a permis de prévenir de nombreux décès et complications lors d'interventions chirurgicales courantes et non urgentes au Canada et à l'étranger3.
La recherche axée sur le patient consiste en un continuum de recherche, allant des recherches initiales sur des humains jusqu'aux études comparatives sur l'efficacité et les résultats, et son intégration au système de santé et aux pratiques cliniques. Ce continuum comprend des études sur des thérapies, des outils diagnostiques, des médicaments et des stratégies de prévention, ainsi que l'évaluation de ces interventions les unes par rapport aux autres et comparativement à des pratiques existantes. Il se termine par la synthèse, la diffusion et l'intégration des données scientifiques au système de santé et aux pratiques cliniques. La recherche axée sur le patient couvre donc à la fois la recherche clinique et la recherche sur les services de santé, ainsi que la synthèse, la diffusion et l'intégration de ces nouvelles connaissances au système de santé et aux pratiques cliniques.
La recherche axée sur le patient s'intéresse aux soins prodigués aux patients en contexte clinique, par opposition à l'étude de populations entières, même s'il fait peu de doute que les résultats en santé reposent en partie sur les déterminants sociaux et qu'il existe de fortes synergies entre la recherche axée sur le patient et la recherche en santé des populations. Ce fait souligne la nécessité de continuer de développer la recherche en santé des populations au Canada et de bâtir des ponts solides entre ces deux domaines de recherche.
Bien que la recherche axée sur le patient commence là où la recherche biomédicale et préclinique se termine, les deux sont également essentielles et forcément complémentaires. En fait, les échanges entre la recherche biomédicale fondamentale et la recherche axée sur le patient sont bidirectionnels, car les observations issues de la recherche axée sur le patient peuvent inspirer de nouvelles questions de recherche biomédicale.
Même si les nouvelles découvertes constituent un objectif clé de la recherche axée sur le patient, il est tout aussi important de comparer les découvertes aux traitements existants (figure 1, encadré de droite) afin de déterminer quelles interventions sont les plus bénéfiques dans le cadre des soins habituels. Cette recherche comparative sur l'efficacité des traitements complète les études visant à démontrer l'efficacité et l'innocuité des nouveaux médicaments ou dispositifs médicaux avant leur introduction en pratique clinique (figure 1, encadré de gauche).
La recherche axée sur le patient peut être menée par des cliniciens-chercheurs issus de tous les milieux professionnels de la santé (infirmières, médecins, dentistes, chiropraticiens, pharmaciens, physiothérapeutes, etc.), par des épidémiologistes cliniques et même par des non-cliniciens (biostatisticiens, économistes de la santé, anthropologues, sociologues, spécialistes du comportement, etc.). Elle peut aussi se dérouler dans tous les contextes cliniques (soins primaires, soins tertiaires, soins de longue durée, soins à domicile ou soins communautaires), c'est-à-dire partout où des patients demandent ou reçoivent des soins.
Le thème « recherche axée sur le patient », relativement nouveau, dénote un niveau d'engagement supérieur du patient dans le processus de recherche clinique et d'application des connaissances. D'ailleurs, il est de plus en plus reconnu que la recherche en santé doit évaluer les interventions et les résultats considérés importants par les patients et les cliniciens, de façon à éviter des décalages coûteux entre la recherche et les besoins. L'évolution rapide des thérapies antivirales contre le VIH témoigne éloquemment de la contribution précieuse des groupes de patients4.
Figure 1 : Processus de conception et de comparaison des interventions cliniques
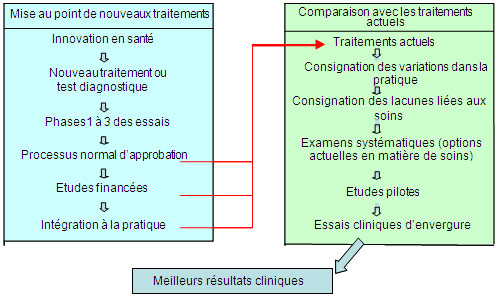
La figure 1 illustre la marche à suivre pour démontrer l'efficacité d'un médicament ou d'un instrument pour sauver des vies ou réduire la morbidité. Ce processus par étape requiert souvent de 15 à 20 ans pour les nouvelles interventions, et de 5 à 7 ans pour la comparaison de thérapies existantes.
1.2 Pourquoi avons-nous besoin aujourd'hui d'une stratégie de recherche axée sur le patient?
Bien que la recherche clinique ait préparé le terrain pour la conception et la mise en pratique d'interventions en santé, l'évaluation comparative de ces interventions, qui aide à déterminer qui cibler et quand, n'a pas progressé au même rythme. De plus, certains facteurs de l'environnement canadien ont accentué le besoin de créer et de mettre en oeuvre une vaste stratégie nationale de recherche axée sur le patient.
Premièrement, même si les investissements en recherche en santé ont permis de mettre au point un large éventail d'interventions préventives, diagnostiques et thérapeutiques, la lenteur du processus d'application des découvertes scientifiques sous forme de produits et d'interventions exaspère de plus en plus les cliniciens, les responsables des politiques et les patients. Les progrès dans la mise au point et l'amélioration des traitements curatifs ne sont pas assez rapides selon plusieurs, surtout pour des maladies comme le cancer, les maladies mentales, la maladie d'Alzheimer et d'autres troubles neurologiques. De plus, la mise en pratique des interventions varie souvent de façon spectaculaire entre professionnels, établissements et systèmes de santé5.
Deuxièmement, le sérieux manque de données sur l'efficacité comparative rend difficile la formulation de lignes directrices cliniques. Cette lacune est maintenant considérée comme l'une des principales causes des variations dans les soins prodigués6-11. En effet, plusieurs études démontrent que moins de 60 % des décisions médicales prises au chevet des patients s'appuient sur suffisamment de données scientifiques12-14 et que jusqu'à 25 % des patients obtiennent des soins inutiles ou potentiellement dangereux15. Nous savons aussi que les patients traités dans les établissements activement engagés dans la recherche obtiennent de meilleurs résultats16,17. Les patients et les professionnels de la santé ont le droit de s'attendre à ce que les décisions médicales importantes reposent sur des preuves scientifiques solides.
Troisièmement, en période de ralentissement économique, les bailleurs de fonds de la recherche biomédicale fondamentale, dont les gouvernements fédéral et provinciaux, et les organismes bénévoles en matière de santé, sont impatients de voir et d'expliquer aux contribuables les retombées des milliards de dollars investis dans la recherche scientifique. Les gouvernements provinciaux, qui doivent faire face à une baisse de leurs revenus, conjuguée à une hausse des coûts des soins de santé, sont impatients non seulement de voir de nouvelles découvertes sur le marché, mais aussi de profiter des comparaisons entre les nouvelles découvertes et les thérapies actuelles. Cette information nous renseignerait sur les résultats et la rentabilité, ce qui permettrait de canaliser les ressources vers les interventions et les méthodes diagnostiques les plus efficaces et, peut-être, de générer des économies majeures. En effet, la recherche axée sur le patient ne consiste pas seulement à améliorer les façons de faire, mais aussi à cesser de poser des gestes reconnus comme inefficaces, inutiles et souvent coûteux.
Quatrièmement, les investissements gouvernementaux soutenus en recherche en santé au cours de la dernière décennie ont permis de nombreux progrès qui ont valu aux chercheurs canadiens une reconnaissance internationale, mais il subsiste de nombreux défis en santé qui résistent aux approches actuelles, en plus des nouveaux défis qui se présentent. Le vieillissement de la population entraîne une hausse des comorbidités, ce qui fait craindre que nous ayons un urgent besoin de nouvelles approches de gestion des maladies chroniques. Les besoins en matière de santé de certaines sous-populations importantes dans les grands centres urbains et de populations isolées dans les régions rurales, nordiques et éloignées, posent des défis supplémentaires et ne sont pas comblés de façon optimale. Les Canadiens, en tant que consommateurs de services de santé, connaissent de mieux en mieux les soins de santé et ont accès à une quantité énorme d'information, scientifique et autre, ce qui accentue les pressions et les attentes en matière de résultats. L'intérêt accru pour les soins auto-administrés et les promesses de la médecine personnalisée ajoutent à l'urgence de mieux utiliser nos ressources en santé.
Le Canada est loin d'être inactif en recherche axée sur le patient. Mais la réalité économique des provinces et des territoires, les défis de santé persistants et émergents et la croissance des attentes des fournisseurs et des patients sont autant d'arguments en faveur d'une stratégie collective détaillée comme voie à suivre. Le Canada doit s'y mettre dès maintenant, car la démonstration de l'impact de la recherche n'est pas une mince tâche et nécessite souvent plusieurs années. Ce décalage est amplifié par la géographie du Canada, sa faible densité de population (surtout dans le Nord), son caractère multiethnique et la complexité de sa structure fédérale-provinciale-territoriale. Il est donc urgent de procéder aujourd'hui à l'adoption d'une stratégie commune réfléchie.
Heureusement, le Canada possède des atouts sur lesquels il peut bâtir, et les Canadiens conviennent que notre pays peut faire mieux. Il existe aussi de nombreux modèles, au Canada et à l'étranger, qui peuvent nous inspirer et être adaptés à nos différents contextes. Bref, les besoins sont grands, les retombées potentielles sont immenses, et le Canada est prêt.
2.0 Le paysage canadien
2.1 Les fondations du Canada
Le système de santé public de haute qualité du Canada permet à tous les Canadiens d'avoir accès à des soins de santé. Puisque les « soins habituels » constituent le comparateur dans les études cliniques, la qualité et l'uniformité des soins de santé représentent un avantage certain dans la recherche axée sur le patient.
Le système universitaire public dans toutes les régions du pays a permis de développer une solide communauté de chercheurs biomédicaux, qui produit les connaissances brutes à mettre en pratique et possède une longue tradition de collaboration efficace avec les chercheurs cliniques.
Les professionnels de la santé dévoués du Canada se répartissent entre les centres de santé universitaires, les autorités sanitaires régionales, les hôpitaux et centres de santé communautaires, les unités de santé publique, les établissements de soins primaires, les maisons de soins infirmiers, les écoles et les organismes gouvernementaux de tout le pays.
Les chercheurs cliniques et les chercheurs sur les services de santé hautement qualifiés du Canada se retrouvent dans des universités, 100 hôpitaux universitaires et d'autres centres de tout le pays et dans de nombreuses disciplines. Bien que hautement concentrés dans les soins tertiaires, on les retrouve aussi dans les milieux de soins primaires et communautaires. Il s'agit notamment de cliniciens et d'autres professionnels de la santé qui effectuent de la recherche, ainsi que de biostatisticiens, d'économistes de la santé, d'épidémiologistes et de spécialistes en sciences sociales (p. ex. des psychologues, des sociologues, des chercheurs sur les services de santé). Cela couvre aussi les infirmières de recherche, les adjoints de recherche et le personnel de soutien en recherche.
Les cliniciens et les chercheurs canadiens du domaine de la santé appliquée ont eu la chance de diriger ou de participer à des études qui ont produit des découvertes publiées dans de nombreux domaines, notamment la cardiologie18,19 les soins intensifs20, les accidents vasculaires cérébraux21, le VIH22, les soins aux prématurés23, la gestion de la douleur24 et l'oncologie25. Les réseaux de recherche clinique organisés par thèmes (p. ex. le Groupe des essais cliniques de l'Institut national du cancer du Canada26, le Groupes des essais cliniques sur le VIH27 et le Canadian Critical Care Trials Group28) ont fait l'objet d'articles dans des revues internationales prestigieuses. En effet, les chercheurs cliniques du Canada « jouent dans la cour des grands » sur la scène internationale depuis un certain temps, comme en témoigne leur taux de citation dans des revues scientifiques (figure 2).
Figure 2 : Impact du Canada sur la recherche en santé à l'échelle internationale
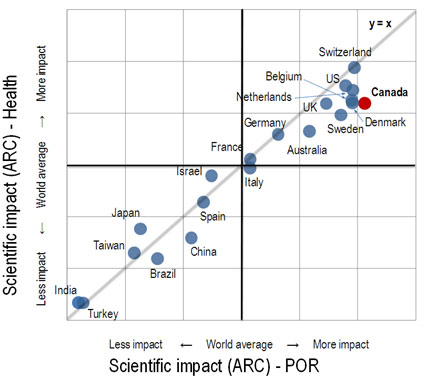
Source : « Patient-Oriented Research in Canada: A Bibliometric Analysis », Science-Metrix, 2009.
La figure 2 illustre l'impact du Canada sur la recherche en santé à l'échelle internationale. En 2009, le Canada se situait dans le peloton de tête, avec le Royaume-Uni, la Belgique, les Pays-Bas, le Danemark et les États-Unis, sur le plan de l'impact scientifique dans l'ensemble du secteur de la santé (ordonnée), mais se classait premier en recherche axée sur le patient (abscisse).
L'expertise du Canada en examens systématiques est reconnue internationalement. En plus de réaliser une part majoritaire des méta-analyses et des examens systématiques d'envergure, les spécialistes canadiens apportent une grande contribution au développement scientifique de ce volet important de la recherche. Les examens systématiques constituent le fondement des pratiques et des lignes directrices cliniques fondées sur des données scientifiques, en plus de constituer une étape obligée dans le processus de planification de vastes études cliniques comparatives. Il s'agit maintenant de la forme de recherche clinique la plus fréquemment citée29.
Le Canada figure parmi les fondateurs de la Collaboration Cochrane, un réseau international sans but lucratif qui aide les fournisseurs de soins de santé, les responsables des politiques, les patients et les soignants à prendre de meilleures décisions en matière de soins, par la préparation d'examens systématiques accessibles et à jour. Parmi les contributions canadiennes, citons le Réseau-centre canadien Cochrane, financé par les IRSC (qui abrite le groupe Cochrane sur les pratiques et l'organisation efficaces des soins), qui effectue des examens systématiques sur l'efficacité des interventions afin d'orienter les pratiques professionnelles.
L'Agence canadienne des médicaments et des technologies de la santé (ACMTS), un organisme pancanadien d'évaluation des technologies de la santé, contribue à la prise de décision fondée sur des preuves scientifiques en donnant accès à des outils d'évaluation technologiques et d'autres outils, dans le but de promouvoir l'utilisation optimale des médicaments, des instruments et d'autres technologies de la santé, sur la base de ses propres examens systématiques et méta-analyses.
Le Groupe d'étude canadien sur les soins de santé préventifs, remis en activité en 2010 par l'Agence de la santé publique du Canada (ASPC), se charge de produire et de diffuser des recommandations cliniques pour les soins primaires et préventifs, sur la base d'un examen systématique des données scientifiques existantes. Les IRSC et l'ASPC ont récemment financé un centre de synthèse des preuves scientifiques à l'Université McMaster afin de combler les besoins du Groupe d'étude en matière de synthèses de connaissances.
Les vastes bases de données administratives et cliniques provinciales et nationales du Canada, comme celles du Régime d'assurance-santé de l'Ontario et de l'Institut canadien d'information sur la santé (ICIS), permettent aux chercheurs de déceler les tendances dans la prestation des soins, d'établir des corrélations importantes entre les interventions et les résultats et d'observer les variations dans les pratiques. Les centres comme l'Institut de recherche en services de santé (IRSS) de l'Ontario, le Centre d'élaboration et d'évaluation de la politique des soins de santé du Manitoba et la base de données couplées en matière de santé de la Colombie-Britannique, permettent de coupler de façon anonyme des renseignements individuels en santé des populations à l'aide d'identificateurs uniques qui assurent la confidentialité de l'information. Cela permet donc d'obtenir une vision plus globale des questions de santé qu'avec des données non couplées. Il est ainsi possible de repérer les lacunes dans les soins de santé, surtout en ce qui concerne l'utilisation des nouvelles options de traitement, et mettre en évidence les problèmes d'innocuité de certains médicaments ou les variations dans la pratique.
Les médicaments sont maintenant soumis à une surveillance et à une évaluation après leur mise en marché à la suite de nouveaux investissements conjoints des IRSC, de Santé Canada et d'intervenants de tout le pays dans le Réseau sur l'innocuité et l'efficacité des médicaments, ce qui représente un pas dans la bonne direction pour l'accroissement du bassin de données dans tout le continuum des soins.
Les récents investissements fédéraux dans l'Inforoute Santé du Canada aident les provinces à accélérer l'introduction des dossiers médicaux électroniques, qui sont essentiels à la prestation de soins axés sur le patient. Les dossiers médicaux électroniques ont le potentiel de réduire la duplication des tests, d'améliorer les diagnostics, de faciliter la collaboration entre médecins, infirmières et autres fournisseurs de soins, de rendre les soins plus efficaces et complets et, ultimement, d'améliorer la santé des Canadiens. Malheureusement, les dossiers médicaux électroniques sont introduits plus lentement que prévu dans les provinces. À l'heure actuelle, environ la moitié des Canadiens possèdent un dossier médical en format électronique, mais moins de 20 % possèdent un dossier de santé électronique qui regroupe tous leurs renseignements médicaux et les rend accessibles aux professionnels de la santé30.
La vaste expérience du Canada dans la création et l'entretien de réseaux cliniques établit des fondations solides sur lesquelles bâtir. Le Programme des Réseaux de centres d'excellence (RCE), qui existe depuis 20 ans, est reconnu internationalement comme un modèle de réseau innovateur qui supprime les barrières entre disciplines, établissements et secteurs. Le programme couvre le budget de fonctionnement des réseaux, qui sont soumis à des exigences en matière d'application des connaissances, notamment de commercialisation de la recherche. On attend aussi des RCE qu'ils assurent leur viabilité après l'expiration du financement fédéral, mais très peu ont respecté ce critère de viabilité. Certains réseaux de recherche en santé, comme le Réseau canadien contre les accidents cérébraux vasculaires, le Réseau canadien de l'arthrite et le Réseau de cellules souches, ont été subventionnés pendant les quatorze ans alloués et leur influence considérable dans leur domaine respectif est largement reconnue.
Une analyse du contexte des réseaux de recherche clinique au Canada31 récemment effectuée pour le compte des IRSC a révélé une grande variété de ce genre de réseaux au Canada, principalement d'envergure nationale et largement axés sur une maladie en particulier. Les plus communs sont les « réseaux spécialisés », qui recherchent une solution à un problème de santé particulier, les « réseaux d'essais cliniques » et les « réseaux d'assurance de la qualité » axés sur la modification des façons de faire des fournisseurs. Les subventions de recherche sont de loin la source de financement la plus commune de ces réseaux. L'analyse a révélé que ceux-ci possèdent généralement un plan stratégique, mais plus rarement des protocoles sur l'échange de données, la propriété intellectuelle ou la publication. Leurs priorités sont déterminées la plupart du temps par les objectifs scientifiques et les besoins des bailleurs de fonds, mais beaucoup plus rarement avec la participation des patients. La question de la viabilité est l'enjeu le plus souvent cité dans l'analyse par les réseaux de recherche clinique.
De nombreux autres réseaux informels sont apparus dans tout le pays. Ces réseaux reposent souvent sur le partage de subventions individuelles et sur la volonté des chercheurs de travailler ensemble. Ils sont donc actifs lorsque les fonds le permettent, et tendent à se démanteler à l'expiration du financement. Par exemple, quelque 120 réseaux informels ont été recensés dans le domaine de la santé des enfants et des adolescents seulement. L'établissement du Réseau de recherche en santé des enfants et des mères (RRSEM), en 2006, est le fruit d'une collaboration visant à regrouper les réseaux existants dans ce domaine. Ses principaux objectifs consistent à créer des plateformes innovatrices pour combler les lacunes en recherche clinique et améliorer les partenariats, la formation, l'application des connaissances et les méthodes de recherche. Il vise aussi à offrir un accès intégré aux nouveaux outils de gestion de données, de génomique et de gestion de biobanques.
La stratégie des sciences et de la technologie du gouvernement du Canada, annoncée en 2007, fournit un cadre important pour la Stratégie de recherche axée sur le patient, car elle met l'accent sur l'excellence scientifique, la mise en pratique des connaissances, la réduction des barrières et le développement de la réserve de talents.
Des efforts récents visant à améliorer la cohérence de la recherche en santé au Canada ont permis d'améliorer l'échange de données et de rationaliser les processus grâce à la collaboration des bailleurs de fonds de la recherche en santé, dont les IRSC et les organismes provinciaux, universitaires et bénévoles de ce secteur. Ces organismes sont résolus à continuer d'harmoniser leurs processus et à régler les problèmes d'inefficacité qui ont nui à la recherche clinique par le passé.
2.2 Deux fossés entre la recherche et la pratique
Bien que le Canada puisse appuyer ses efforts sur des fondations solides, certains facteurs conjuguent leurs effets pour entraver la circulation de l'information provenant de la recherche biomédicale vers la recherche clinique, puis vers l'amélioration des soins aux patients et des résultats positifs pour la santé.
En effet, le continuum recherche-pratique traverse un double passage à vide au Canada, souvent appelé les deux fossés (figure 3). Le premier fossé représente la diminution de la capacité d'application des résultats de la recherche biomédicale fondamentale sous forme d'avantages pour le patient, et de la capacité de commercialiser les découvertes en santé. Cela influe négativement sur la recherche et les connaissances cliniques du Canada et sur sa compétitivité internationale. Le second fossé est la capacité limitée de synthétiser, de diffuser et d'intégrer les résultats de la recherche de façon plus systématique aux pratiques cliniques et au processus décisionnel en santé. Le Canada doit combler ces fossés pour que la science contribue à l'amélioration des résultats sur le plan de la santé et que son système de santé demeure viable32.
Figure 3 : Les deux fossés du continuum recherche-pratique
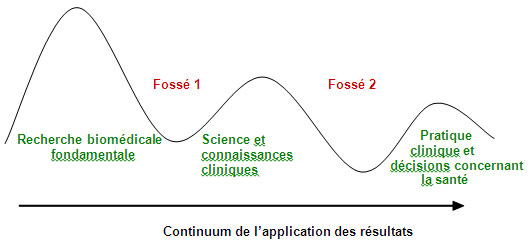
Adaptation du travail de Steven Reis, Université de Pittsburgh, et d'Harold Pincus, Université Columbia.
2.3 Principaux facteurs favorables
2.3.1 Décentralisation du pouvoir et de l'établissement des priorités
La structure fédérale décentralisée du Canada pose des défis particuliers en matière de direction et de coordination de la recherche axée sur le patient.
Les gouvernements fédéral et provinciaux possèdent des responsabilités distinctes, mais parfois entrecroisées, pour le financement et la réglementation des soins de santé et de la recherche en santé.
Même si la santé relève principalement des provinces, le gouvernement fédéral assume quelques rôles importants. Il possède le pouvoir de réglementation sur un large éventail de produits pharmaceutiques, thérapeutiques, alimentaires et de consommation, et sur de nombreux aspects de la reproduction assistée, pour lesquels il fixe des normes de sécurité, d'efficacité et de qualité. C'est aussi le fournisseur de services de santé des populations qui relèvent de la compétence fédérale, notamment les Premières Nations et les Inuits, mais aussi les anciens combattants, les détenus des pénitenciers fédéraux et le personnel du ministère de la Défense nationale et de la GRC. Il fait équipe avec les provinces et les territoires dans le développement et l'entretien du système de santé universel du Canada par l'entremise du Transfert canadien en matière de santé et de la Loi canadienne sur la santé, ainsi que par le financement de quelques organismes de santé nationaux, dont l'ICIS, l'Inforoute Santé du Canada, l'ACMTS, le Conseil de la santé, la Commission de la santé mentale, l'Institut canadien pour la sécurité des patients et le Partenariat canadien contre le cancer. Enfin, le gouvernement fédéral joue un rôle reconnu en santé publique et en promotion de la santé, surtout par l'entremise de l'Agence de la santé publique du Canada, mais aussi par des programmes de Santé Canada (p. ex. la planification d'urgence en santé, les stratégies de gestion des maladies infectieuses, la surveillance de la santé publique et l'application de mesures réglementaires et fiscales pour promouvoir de saines habitudes de vie).
Les provinces ont la responsabilité de planifier et de financer la plupart des services de santé et de soutenir les établissements importants où s'effectuent des travaux de recherche axée sur le patient. Elles produisent les cliniciens et les chercheurs qui sont au coeur de la recherche axée sur le patient, ainsi que les fournisseurs et les administrateurs de services de santé qui sont les destinataires des nouvelles connaissances et les appliquent sous forme d'amélioration des soins de santé, en plus d'interagir directement avec les patients et leur famille.
Les deux ordres de gouvernement investissent considérablement dans la recherche en santé. Les investissements fédéraux sont surtout effectués par l'entremise des IRSC, mais aussi de programmes et d'organismes comme Génome Canada, la Fondation canadienne pour l'innovation (FCI), la Fondation canadienne de la recherche sur les services de santé (FCRSS), le Programme des bourses d'études supérieures du Canada, les Chaires de recherche du Canada, le Programme des coûts indirects et, depuis peu, les Bourses d'études supérieures du Canada Vanier et le Programme de bourses postdoctorales Banting. Les gouvernements provinciaux financent la recherche en santé de façon directe par l'entremise de leurs organismes de financement de la recherche en santé et, indirectement, par leurs investissements dans les universités et les centres de santé universitaires où la recherche en santé est réalisée. Ce sont aussi des partenaires financiers fréquents de certaines initiatives de la FCI et de la FCRSS.
Ce partage des rôles, quoique fécond sur un certain plan, peut nuire à la coordination de la recherche axée sur le patient et conduire à des problèmes d'efficacité et de rendement. Cette structure signifie surtout l'absence de normes nationales et la difficulté d'échanger des données sur les patients et l'utilisation des services entre les provinces. Il est essentiel de se doter de normes nationales, car la recherche dépasse de plus en plus le cadre provincial. L'approche désorganisée de formulation et d'introduction des lignes directrices cliniques et la durée excessive du processus d'examen éthique pour les essais multicentriques à grande échelle sont des exemples des conséquences de ces différences provinciales.
De plus, les investissements fédéraux et provinciaux actuels dans la recherche axée sur le patient ne sont pas guidés par une stratégie générale ou des priorités communes fondées sur les besoins et les préférences des Canadiens. Ils ne sont pas non plus proportionnels au poids relatif des maladies29. Quelques provinces établissent des priorités de recherche en santé de plus en plus axées sur les soins primaires et la gestion des maladies chroniques. Mais le Canada demeure dépourvu d'un mécanisme permettant de mobiliser tous les intervenants concernés pour établir des priorités nationales de recherche en santé et collaborer afin de réduire les chevauchements et répartir de façon optimale l'expertise clinique dans le pays.
2.3.2 Lacunes dans la formation et le soutien professionnel des ressources humaines
Comme nous l'avons vu, la main-d'oeuvre clinique du Canada compte un nombre impressionnant de scientifiques hautement spécialisés et reconnus internationalement. Cependant, il existe des lacunes importantes et grandissantes dans la capacité de recherche clinique, ainsi que des pénuries inquiétantes de biostatisticiens, d'économistes de la santé, d'épidémiologistes cliniques et de spécialistes des sciences sociales se consacrant à la recherche clinique. Les leaders de la communauté scientifique ont aussi souligné le manque de personnel de recherche non clinique et de personnel de soutien en recherche, comme des coordonnateurs de projets et des adjoints de recherche dûment formés.
Dans le rapport de 2002 des IRSC intitulé Le clinicien-chercheur : hier, aujourd'hui et demain, on soulignait que tous les types de chercheurs cliniques trouvaient de plus en plus difficile de demeurer actifs en recherche, étant souvent accaparés par leur travail clinique et leur charge d'enseignement, souvent en raison de la pénurie de professionnels de la santé dans leur domaine particulier. Compte tenu du temps relativement limité qu'ils peuvent consacrer à la recherche, les chercheurs cliniques ont souvent du mal à obtenir leur part de soutien professionnel dans le système de financement actuel.
Voici des exemples d'obstacles qui empêchent les chercheurs cliniques d'entreprendre ou de poursuivre une carrière en recherche :
- la pénurie de mentors et de chercheurs célèbres suscitant l'émulation;
- le manque de possibilités d'acquérir la formation nécessaire;
- une charge de travail clinique élevée;
- la difficulté de se faire libérer du temps de recherche par les chefs de service ou de département;
- une première expérience en recherche négative;
- l'absence d'équipe;
- le manque de soutien méthodologique;
- une rémunération insuffisante33-38.
Ainsi, malgré les efforts fournis par les IRSC et les gouvernements provinciaux pour remédier à cet état de choses, les auteurs de nombreux rapports39-44 s'entendent pour dire que le Canada n'arrive pas vraiment à gérer cette pénurie de cliniciens-chercheurs. Dans le dernier sondage national de l'Association médicale canadienne, de 4 à 7 % des médecins ont dit consacrer plus de 20 heures par semaine à la recherche, une proportion constante depuis les dix dernières années malgré la forte hausse du budget de recherche de 2000 à 200745.
Les données ne montrent aucune augmentation du nombre d'étudiants et de jeunes professionnels de la santé choisissant une carrière en recherche et bénéficiant d'un financement des IRSC ou d'organismes provinciaux. Le nombre de bourses de formation et d'appui salarial décernées à des médecins par les IRSC est demeuré relativement stable. En revanche, le financement consacré à ces bourses a augmenté de 50 % au cours des cinq dernières années pour les chercheurs biomédicaux et a suivi une tendance à la baisse pour les médecins (figure 4). De même, le nombre de bourses provinciales de formation et d'appui salarial remises aux médecins n'a pas augmenté depuis cinq ans (figure 5). Les IRSC, tout comme les gouvernements provinciaux, accordent même moins de bourses au personnel infirmier, catégorie dont le financement a fait du sur place pendant la même période. Dans l'ensemble, les IRSC et les provinces ont investi massivement dans les carrières des chercheurs biomédicaux, mais les professionnels de la santé et les cliniciens n'ont pas été autant soutenus.
La création de la Fondation canadienne de la recherche sur les services de santé (FCRSS) par le gouvernement fédéral, il y a plus d'une décennie, a stimulé la croissance du bassin de chercheurs en services de santé, qui était alors largement insuffisant. Les exigences uniques en matière de financement de contrepartie rattachées aux subventions de recherche ont permis de réunir des chercheurs sur le système de santé avec des utilisateurs de cette recherche de façon à promouvoir son application dans la pratique. Cela constituait, à plusieurs égards, une « première » excitante en recherche axée sur le patient au Canada. L'initiative Formation en utilisation de la recherche pour cadres qui exercent dans la santé (FORCES) est un autre programme innovateur de la FCRSS qui vise à développer les capacités et le leadership nécessaires à une application optimale des preuves scientifiques aux pratiques cliniques et à la gestion des organismes de santé du Canada. Malheureusement, la dissolution progressive de la Fondation a ralenti ces progrès, et ce, malgré le transfert aux IRSC de la portion du mandat de la FCRSS relative aux subventions de fonctionnement.
Le niveau de soutien offert aux biostatisticiens et aux autres spécialistes de la méthodologie est aussi très préoccupant. Les biostatisticiens sont essentiels à la recherche axée sur le patient, mais comme ils sont souvent des employés salariés des universités, plutôt que d'être financés par des subventions, ils sont très vulnérables aux réductions budgétaires. Le Canada fait face également à une pénurie d'économistes de la santé et d'épidémiologistes cliniques. Étant donné l'intérêt accru pour les soins basés sur des données scientifiques, ces experts deviendront de plus en plus en demande.
Figure 4 : Nombre total de bourses de formation et d'appui salarial décernées par les IRSC
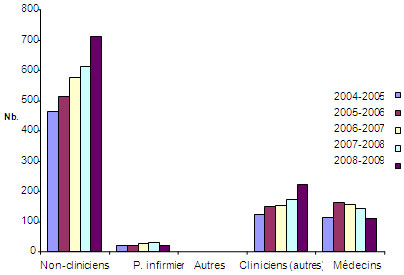
La figure 4 représente le nombre total de bourses de formation et d'appui salarial versées annuellement par les IRSC à des médecins, des infirmières et d'autres cliniciens entre 2004-2005 et 2008-2009, en comparaison du nombre de bourses de formation et d'appui salarial versées à des chercheurs non cliniciens durant la même période. Les données révèlent que le nombre de bourses est resté stable pour les infirmières, qu'il a légèrement augmenté pour les autres cliniciens, qu'il a augmenté plus fortement pour les non-cliniciens et qu'il a diminué pour les médecins.
Figure 5 : Nombre total de bourses de formation et d'appui salarial décernées par les provinces
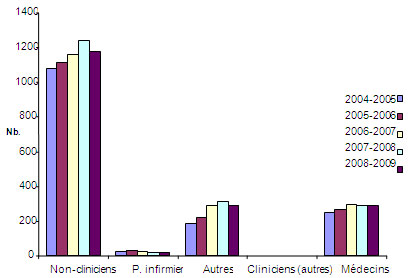
La figure 5 représente le nombre total de bourses de formation et d'appui salarial versées annuellement par certaines provinces (Alberta, Colombie-Britannique, Manitoba, Nouvelle-Écosse, Ontario et Québec) à des médecins, des infirmières et d'autres cliniciens entre 2004-2005 et 2008-2009. Les données ne révèlent pas de variation notable du nombre de bourses versées aux chercheurs cliniques, mais indiquent une légère baisse récente du nombre de bourses versées aux non-cliniciens.
Sources : 1) Données provinciales de l'Alliance nationale des organismes de recherche en santé provinciaux (ANORSP); 2) Données canadiennes de la base de données des IRSC (SIE).
Ce manque de soutien aux professionnels de la santé voulant faire carrière en recherche pose un grave problème pour la recherche axée sur le patient. En effet, sans ce personnel hautement qualifié, les centres de recherche axée sur le patient seront incapables d'offrir le soutien nécessaire aux professionnels de la santé et aux chercheurs locaux, de contribuer à développer des thèmes régionaux d'excellence et de participer à des travaux de recherche à l'échelle nationale. De plus, ils ne pourront pas coordonner les activités à l'échelle locale ou recruter des patients supplémentaires pour les besoins d'essais cliniques.
2.3.3 Contraintes financières
Investissements du secteur public
Selon leurs derniers calculs, les IRSC - principal organisme public de financement de la recherche axée sur le patient au Canada - investissent environ 115 millions de dollars par année, soit environ 12 % de leur budget actuel, dans le financement de cette recherche dans le cadre de leurs divers programmes de bourses et de subventions ouvertes et stratégiques. Ce chiffre n'inclut pas le soutien financier accordé à divers réseaux, plateformes et activités d'application des connaissances dites « axées sur le patient ». Les investissements publics dans la recherche axée sur le patient au Canada couvrent aussi ceux des provinces et des donateurs par le biais des organismes bénévoles en matière de santé du Canada.
À l'heure actuelle, les investissements publics au Canada dans les études cliniques multicentriques à grande échelle sont limités. Cela s'explique principalement par le fait que le coût de ces études a considérablement augmenté en raison des nouveaux règlements applicables à la recherche, de l'alourdissement du fardeau administratif et, dans certains cas, de la portée internationale des études46. Pourtant, nous avons de plus en plus besoin d'études interventionnelles et d'essais à une échelle suffisante pour examiner des questions cliniques importantes, et de projets de recherche par observation permettant de cerner des lacunes en santé dans plusieurs centres. Les résultats de ce genre d'études fournissent les bases nécessaires à des recommandations fermes concernant le diagnostic, le pronostic et le traitement des patients. Les coûts sans cesse croissants et les limites du financement public obligent les chercheurs en quête de financement à faire appel à des partenaires du secteur privé et à des organismes gouvernementaux ou de bienfaisance pour réunir les fonds nécessaires à un projet de grande envergure. Ce processus peut prendre plusieurs années, même dans le cas d'études qui pourraient éventuellement changer les pratiques.
À ces difficultés de financement est venue s'ajouter récemment une diminution de l'aide financière indirecte des universités et du secteur hospitalier. Auparavant, les départements universitaires fournissaient une aide salariale aux chercheurs et leur allouaient du temps pour réaliser leurs travaux, et les hôpitaux leur permettaient d'utiliser les laboratoires cliniques et les tests diagnostiques. Malheureusement, dans l'ensemble des provinces et territoires, les contraintes budgétaires ont obligé les établissements à privilégier le recouvrement des coûts. Résultat : le matériel, les installations et le personnel sont désormais réservés aux cliniciens-chercheurs dotés d'un financement leur permettant de rembourser l'établissement hôte. Cela limite ainsi la capacité à réaliser des travaux de recherche axés sur le patient.
Investissements du secteur privé
Le Canada présente un dossier solide au chapitre des partenariats entre les universités et l'industrie pharmaceutique. En effet, les dix principales sociétés pharmaceutiques ont consacré plus de 1,3 milliard de dollars à la recherche et au développement au Canada en 2007. De ce montant, 600 millions de dollars ont été investis dans des essais cliniques, ce qui représente 78 % des dépenses totales en recherche appliquée47. Toutefois, comme dans les autres pays occidentaux, les processus de recrutement des patients et d'exécution des essais, jugés longs et coûteux, ont poussé les responsables canadiens à préférer les pays en développement pour ce genre d'essais46. C'est pourquoi les investissements de l'industrie pharmaceutique canadienne en recherche clinique et en recherche-développement sont demeurés stables au Canada au cours des cinq dernières années, en dépit d'une croissance mondiale48 (figure 6).
La situation du Canada en tant que chef de file mondial de la recherche clinique est aujourd'hui compromise par la vive compétition que lui font l'Europe de l'Est, l'Inde, la Chine, le Brésil et la Russie. Ces pays offrent un accès rapide à un grand nombre de patients et les coûts de la recherche y sont de 30 % moins élevés que dans les pays occidentaux. De plus, la possibilité de pénétrer les marchés émergents a tout pour séduire les acteurs de l'industrie. Par exemple, le marché chinois connaît une croissance annuelle de 25 %. Désormais, les lacunes observées dans de nombreux pays en développement en ce qui concerne la protection de la propriété intellectuelle ne suffisent plus à dissuader les chercheurs de venir y travailler. En outre, la Chine et l'Inde investissent à coups de milliards pour se doter de l'infrastructure, des capacités et du personnel formé nécessaires pour mener des études cliniques et attirer l'industrie. Par conséquent, la part du Canada dans le monde pour les essais cliniques est tombée à 4,1 %, ce qui représente un déclin relatif moyen de 12 % par année et place notre pays en quatrième position, derrière la France (4,3 %) et l'Allemagne (5,7 %), les États-Unis étant bons premiers avec 49 %49. Malgré cette tendance, des données récentes révèlent que la qualité des essais contrôlés randomisés (ECR) effectués dans les pays développés comme le Canada demeure supérieure à celle des essais réalisés en Chine et en Inde, qui ne répondent pas aux normes de qualité internationales50-52.
De plus, la croissance de l'investissement des multinationales pharmaceutiques dans la recherche et le développement internes au Canada accuse un ralentissement depuis 1999 et est proportionnellement plus faible que dans les pays concurrents, et ce, en dépit de revenus supérieurs. Ainsi, en 2005, les sommes investies en recherche-développement par ces multinationales représentaient 19 % du total des ventes aux États-Unis, 25 % au Royaume-Uni et seulement 9 % au Canada.
Figure 6 : Nombre d'essais cliniques au Canada dirigés ou commandités par l'industrie pharmaceutique de 2003 à 2007
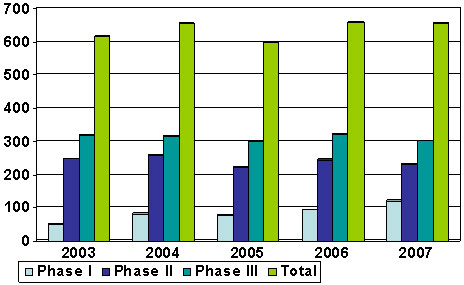
Nombre d'essais cliniques dirigés par l'industrie. On remarque une croissance nulle dans ce secteur, situation à laquelle fait écho la stagnation de l'investissement dans la recherche au Canada entre 2003 et 2007. On note aussi que les chiffres n'ont pas beaucoup changé pour les phases I, II et III depuis 2003.
C'est en mettant au point et en testant des traitements au Canada que l'on garantit aux Canadiens la primeur des nouveaux médicaments et technologies. Cela permet également de former nos professionnels de la santé sur leur utilisation, de faciliter leur diffusion et de profiter de leurs retombées économiques. Quand une étude ne produit pas les avantages escomptés, le gouvernement canadien est alors le mieux placé pour restreindre l'utilisation des médicaments ou traitements en cause. De plus, de tels investissements et partenariats contribuent à instaurer une culture d'analyse en favorisant une remise en question continue des approches existantes en matière de soins aux patients. Nous y gagnons une main-d'oeuvre particulièrement axée sur le savoir et des retombées économiques tangibles.
2.3.4 Absence de données et de plateformes technologiques uniformisées
L'absence de données et de plateformes technologiques uniformisées soutenant un large éventail de projets de recherche en santé regroupant plusieurs établissements, équipes de recherche et provinces constituent une préoccupation importante sur le plan de l'infrastructure. Les plateformes technologiques permettent l'échange d'information sur les projets à l'intérieur de réseaux, la coordination des activités de recherche et l'application de normes communes, en plus de faciliter la mesure des résultats. En outre, ces plateformes peuvent être reliées aux dossiers médicaux électroniques. Même si de nouvelles bases de données administratives, cliniques et d'observation sont mises en place dans différentes régions du Canada, des obstacles continuent d'entraver l'utilisation de ces données à des fins scientifiques par les chercheurs.
Il n'y a souvent pas de normalisation des bases de données quant à la définition des données et au type de données recueillies, ce qui complique les comparaisons nationales et internationales et la mesure des progrès dans le temps. De plus, le processus de filtrage et de couplage des données est long et laborieux, tandis que nous manquons de gestionnaires et d'analystes de données, et une bonne partie des données administratives recueillies demeurent incomplètes.
Les outils de saisie électronique des données (SED), qui facilitent la collecte des données d'essais cliniques, peuvent améliorer la précision des données et réduire le temps nécessaire à leur collecte, en plus d'être utiles à la randomisation. Pourtant, environ 40 % seulement des essais cliniques réalisés au Canada font appel à des outils de SED, et ceux-ci sont beaucoup plus rarement utilisés dans les essais financés par les universités, les gouvernements et les fondations que dans ceux qui sont parrainés par l'industrie53.
Enfin, malgré le développement progressif des dossiers médicaux électroniques, le Canada demeure loin derrière de nombreux autres pays à ce chapitre. De plus, les différentes réglementations provinciales sur la vie privée limitent l'échange de données entre provinces, et l'Inforoute Santé du Canada ne prévoit encore rien pour permettre l'utilisation de cette information précieuse à des fins scientifiques.
2.3.5 Retards dans l'approbation des études cliniques multicentriques à grande échelle
Six rapports récents sur la recherche clinique39-44 soulignent les lacunes importantes du Canada dans la direction et la coordination de la recherche axée sur le patient, en particulier dans les études cliniques, malgré l'énorme impact potentiel de ce type de recherche sur les soins cliniques. La figure 7 illustre les différents types d'études cliniques.
Figure 7 : Types d'études cliniques

La figure 7 illustre les différents types d'études cliniques pour montrer que la recherche clinique ne se limite pas aux essais cliniques54.
Fort de sa solide réputation en recherche clinique, le Canada est actif dans tous les types de recherche clinique, notamment les vastes études par observation, composante essentielle des études comparatives ou des essais cliniques pouvant influencer les pratiques. Dans l'ensemble, les décisions relatives à tous les types de recherche clinique sont généralement perçues comme justifiées et respectueuses de l'intérêt public. Cela dit, il existe un certain nombre d'obstacles systémiques qui causent des problèmes d'inefficacité et des retards importants dans les vastes études cliniques au Canada. Ces problèmes d'inefficacité découlent, en partie, de l'accès aux données et de la pénurie de certains professionnels comme les chercheurs cliniques, les biostatisticiens, les épidémiologistes cliniques et d'autres spécialistes nécessaires.
Au Canada, les vastes ECR multicentriques se heurtent à des obstacles particuliers qui entraînent des retards coûteux dans les approbations.
Le premier obstacle découle de la multiplicité et de la complexité des examens éthiques exigés. À l'heure actuelle, les ECR sont soumis à des examens de l'éthique détaillés dans chaque établissement participant. Cela peut représenter de 30 à 50 approbations et examens distincts et entraîner des retards importants dans l'exécution des essais et mener à l'exclusion de certains centres. L'utilité de ces examens multiples pour la qualité de la surveillance ou la résolution d'importantes questions d'éthique ou de sécurité des patients n'est pas vraiment démontrée. En fait, ces nombreux examens tendent à nuire à la transparence et à la responsabilisation dans la prise de décisions, en plus d'exiger beaucoup de ressources.
Le deuxième obstacle est l'absence de contrat modèle entre établissements participant aux études, et le fait que les processus d'examen et d'approbation des contrats entre l'industrie, les chercheurs et les établissements sont devenus longs et fastidieux. Il n'existe pas de modèle d'entente ou d'entente type accepté par les établissements qui faciliterait la conclusion des contrats. En fait, chaque centre participant à une étude multicentrique fait l'objet d'une négociation séparée. Des recherches ont démontré qu'il faut en moyenne 96 jours par centre pour conclure une entente d'essai clinique dans les universités américaines, comparativement à une période pouvant atteindre 12 mois au Canada55. Plus les essais sont ambitieux, plus le processus est long et laborieux.
2.3.6 Lacunes dans l'élaboration, la diffusion et la mise en pratique des lignes directrices
Les lignes directrices cliniques sont des énoncés formulés de manière systématique pour aider les professionnels de la santé à prodiguer aux patients des soins adéquats et fondés sur des données scientifiques. Elles visent à influencer les pratiques des professionnels de la santé. Cela dit, il s'agit de recommandations, et non de règles, qui facilitent la prise de décision clinique, et ne la remplacent pas.
L'élaboration de lignes directrices cliniques est un processus complexe, rigoureux et coûteux en ressources. Au fil du temps, l'élaboration de recommandations cliniques est passée d'un processus de concertation informel, qui trop souvent aboutissait à des lignes directrices de mauvaise qualité, à un processus plus structuré. Aujourd'hui, le processus tend à être davantage guidé par les données scientifiques que les opinions d'experts. Plus précisément, la formulation de lignes directrices explicites repose sur des preuves scientifiques assorties d'une justification claire, d'une estimation de la possibilité des résultats et d'une comparaison de l'intérêt des résultats en fonction des préférences des patients56.
L'élaboration et la diffusion de lignes directrices cliniques comportent plusieurs étapes. Premièrement, un organisme régional ou national cerne un besoin en matière de soins cliniques. Après la formation d'un comité, les données sont synthétisées par une recherche systématique dans la littérature, y compris dans les recommandations existantes, et une estimation de la valeur des preuves scientifiques. Les données sont ensuite soumises à un examen par les pairs, évaluées à la lumière de l'expérience clinique et transformées en lignes directrices, qui sont soumises à l'approbation du bailleur de fonds et d'autres parties intéressées. Elles sont ensuite diffusées par des envois postaux, des revues scientifiques et d'autres moyens, y compris leur intégration à la formation continue des professionnels de la santé. Enfin, elles sont soumises à une nouvelle évaluation après un certain temps, et le processus reprend du début57.
Les études démontrent avec constance que lorsque les lignes directrices fondées sur des données probantes sont rigoureuses et appliquées efficacement, on assiste à une amélioration de la qualité des soins et des résultats cliniques58. La mise en pratique des nouvelles connaissances scientifiques pourrait aussi engendrer des économies majeures pour le système. Par exemple, si les pratiques étaient modifiées en fonction des connaissances actuelles concernant l'auto-surveillance de la glycémie, plus de 150 millions de dollars seraient libérés pour d'autres dépenses, et ce sans effet négatif sur la santé des patients59.
Pourtant, on constate de sérieuses lacunes dans la qualité des lignes directrices et dans leur application. Par exemple, la multiplication des lignes directrices place souvent les cliniciens devant des recommandations différentes et parfois contradictoires pour une même maladie. La qualité des recommandations est aussi une source de grande préoccupation. Pour de nombreux médecins de première ligne, les recommandations qui se limitent à des maladies uniques sont une source de frustration, car dans la pratique, leurs patients sont de plus en plus âgés et présentent des comorbidités. L'impossibilité de soumettre les recommandations à une évaluation critique de leur qualité est aussi un obstacle à leur adoption. Une étude canadienne montre que les recommandations émises par les auteurs de lignes directrices pharmacologiques étaient utiles aux médecins et aux pharmaciens, mais qu'elles reposaient sur des processus insuffisamment rigoureux ou détaillés60. Une étude plus récente sur la formulation de recommandations au Canada révèle que les processus sous-jacents s'étaient améliorés dans certains secteurs, mais pas tous. Les recommandations récemment produites au Canada sont moins susceptibles de reposer sur un examen des preuves scientifiques, et environ la moitié d'entre elles mentionnent la valeur des preuves scientifiques sous-jacentes61.
Au Canada, divers groupes produisent des lignes directrices - par exemple, des associations professionnelles, des regroupements de cliniciens, des organismes bénévoles en matière de santé -, souvent avec des ressources limitées. Les recommandations canadiennes sur les accidents cérébrovasculaires (ACV), dont la valeur s'est révélée inestimable dans la révision du traitement des ACV, ont été financées par le Réseau canadien contre les ACV dans le cadre de sa subvention de RCE, une source de financement stable qui disparaîtra en 2014. Jusqu'à maintenant, l'industrie pharmaceutique et les fabricants d'instruments médicaux ont été les sources de fonds habituelles pour la production de ces lignes directrices, mais cette source se tarit à mesure que les brevets des médicaments expirent, ainsi que pour d'autres raisons. De plus, en dépit des règlements sévères régissant la réception de ces fonds de l'industrie, les craintes de conflit d'intérêts demeurent élevées chez les patients et le grand public.
Le grand nombre de lignes directrices et d'auteurs cause des chevauchements dans la recherche et l'évaluation des preuves scientifiques. Parfois, certaines lignes directrices restées trop longtemps sans mise à jour ne reflètent plus les dernières connaissances scientifiques.
Par ailleurs, on observe des progrès récents dans les efforts pour combler certaines lacunes. Le Groupe d'étude canadien sur les soins de santé préventifs, reconstitué par l'Agence de la santé publique du Canada (ASPC), est digne de mention. Son mandat consiste à formuler des recommandations cliniques pour les soins primaires et préventifs qui peuvent aider les fournisseurs de soins primaires à offrir des soins préventifs, par l'harmonisation de diverses recommandations préventives et la conception d'outils et de ressources cliniques. Bien que les professionnels de la santé soient les premiers ciblés, d'autres groupes importants seront aussi touchés, comme les professionnels de la santé publique et communautaire (infirmières en santé publique, nutritionnistes), les concepteurs de programmes, les décideurs et le grand public.
La formulation et l'harmonisation de directives cliniques ne représentent qu'un premier pas. Pour être efficaces, elles doivent être largement et régulièrement diffusées dans des formats multiples auprès des médecins et des autres professionnels de la santé en temps opportun, pendant une période soutenue; il peut s'agir aussi d'un processus coûteux et laborieux. L'Association médicale canadienne administre l'Infobase AMC, un dépôt ou une banque de guides de pratiques cliniques canadiennes destinées aux professionnels de la santé. Cependant, ces lignes directrices ne s'adressent qu'aux médecins et non aux autres professionnels de la santé, une lacune importante. Enfin, avec la popularité grandissante des soins auto-administrés et des soins à domicile et le besoin de responsabiliser les gens par rapport à leur santé, il est de plus en plus nécessaire d'adapter ces directives à l'usage des patients, et de trouver de nouvelles voies de communication pour rejoindre ce groupe.
Après toutes ces étapes, l'adoption des recommandations en temps opportun par les praticiens, de façon à optimiser les soins, pose d'autres défis. Les données révèlent des problèmes d'inefficacité importants dans la mise en pratique des lignes directrices. En fait, le plus grand défi lié aux recommandations cliniques est d'assurer leur adoption rapide par les praticiens et les autres professionnels de la santé.
Les raisons de la mise en pratique inadéquate des lignes directrices sont multiples et complexes. En voici quelques-unes :
- la qualité des recommandations;
- les différences entre les professionnels de la santé, y compris leurs traits démographiques comme l'âge et le pays de formation;
- les particularités de l'environnement clinique, notamment les problèmes d'inefficacité systémiques, les obstacles à la mise en pratique, la charge de travail, les facteurs incitatifs ou dissuasifs, l'existence ou l'absence de réglementation par des organismes de certification ou d'octroi de licence;
- les facteurs particuliers à chaque patient, comme les exigences ou les présentations individuelles et l'observance antérieure62.
Malheureusement, la création de lignes directrices qui ne sont pas mises en pratique devient un exercice futile.
2.3.7 Rôle limité des patients dans la recherche axée sur le patient
Les patients et leurs familles jouent normalement le rôle de participant dans la recherche clinique. L'étude du RCRPP sur les réseaux cliniques commandée par les IRSC montre qu'il est rare que les patients ou le public participent à la planification des études réalisées par les réseaux ou à l'analyse ou à la communication de leurs résultats. Pourtant, la recherche démontre de plus en plus l'utilité d'inclure les patients et le public dans le choix des objectifs de recherche nationaux et de tenir compte de leurs préférences et valeurs dans la recherche en santé63. Le rôle limité des patients est une préoccupation grandissante pour plusieurs. La recherche sur les services de santé plaide depuis longtemps en faveur d'une participation accrue des patients et du public au choix des priorités et des objectifs de recherche64-66, et la valeur de cette approche est de plus en plus démontrée.
Dans certains secteurs des soins de santé, en particulier en obstétrique, il existe une longue tradition de participation directe des patients à la remise en question des pratiques et des politiques, souvent dans le sillage d'opinions allant à l'encontre des pratiques reconnues de l'époque. Dans les années 1970, le recours régulier à l'épisiotomie, recommandé par les médecins pour ses avantages par rapport au recours restreint, était souvent remis en cause par les femmes. Les résultats d'une étude clinique ont fini par démontrer l'inutilité de la pratique régulière de cette intervention67. De même, un essai clinique réclamé par les femmes sur les bienfaits des mastectomies radicales ont permis de faire cesser cette procédure invasive lorsque ses bienfaits pour la santé ne se sont pas supérieurs à ceux de la lumpectomie, moins invasive.
La recherche clinique semble toujours démesurément intéressée aux médicaments par rapport à d'autres types d'intervention. Par exemple, les priorités de recherche des patients souffrant d'arthrose du genou et de leurs médecins tendaient à aller du côté d'une évaluation plus rigoureuse des physiothérapies, des chirurgies et des stratégies d'adaptation; seulement 9 % souhaitaient plus de recherche sur les médicaments. Pourtant, plus de 80 % des essais contrôlés randomisés sur des patients souffrant de cette affection portent sur des médicaments. L'intérêt pour les interventions non pharmaceutiques chez les utilisateurs de la recherche se reflète aussi dans le fait que les analyses Cochrane les plus consultées concernent des traitements non pharmaceutiques29.
Les résultats rapportés par les patients suscitent un intérêt grandissant comme information complémentaire aux résultats cliniques. Il s'agit d'un vaste champ d'étude aux États-Unis et en Europe, qui part du principe qu'en axant les essais cliniques sur des résultats médicaux particuliers plutôt que sur l'expérience du patient dans l'utilisation du médicament ou de l'appareil, on risque de mettre au point des médicaments efficaces mais dont les coûts personnels ou les effets sur la qualité de vie des patients sont trop élevés pour en justifier l'utilisation. Un exemple est le cas des personnes atteintes du sida, d'abord aux É.-U., puis au R.-U., qui ont contesté les méthodes d'essai des chercheurs qui ne tenaient pas compte des résultats souhaités par les patients68.
Les personnes handicapées aux États-Unis et les communautés autochtones et les personnes atteintes du VIH/sida au Canada, insistent pour que les patients et le public jouent un rôle plus actif dans la définition des priorités de recherche et pour que la recherche soit plus participative et inclusive : il faut que les patients participent aux décisions qui les concernent.
Des problèmes se posent relativement aux participants à la recherche. Par exemple, il y a remarquablement peu de femmes recrutées dans les essais cliniques au Canada, ce qui fausse parfois les résultats. À cause de leur sous-représentation dans les essais cliniques, les femmes risquent davantage de souffrir des effets indésirables de certains médicaments déjà sur le marché69. De plus, certains médicaments ou appareils qui finissent par être homologués peuvent ne pas fonctionner pour les femmes. Les faibles doses d'aspirine, par exemple, qui se sont d'abord avérées efficaces pour réduire les risques d'infarctus du myocarde chez les hommes, se sont avérées inefficaces plus tard chez les femmes.
Même lorsque les femmes sont recrutées dans les essais cliniques, les résultats ne sont pas nécessairement analysés en fonction du genre. Un examen systématique de la place accordée aux dimensions de genre et de sexe dans les plans de recherche a révélé une amélioration progressive depuis les années 1990, mais il subsiste une sous-représentation étonnante de la recherche axée sur les différences de genre dans les soins aux patients70. En fait, la posologie de la plupart des médicaments n'est pas adaptée au poids des patients. Pour les médicaments qui ont une marge thérapeutique étroite ou une courbe de concentration quasi verticale, les femmes peuvent subir beaucoup plus d'effets indésirables que les hommes.
3.0 Le paysage international
L'innovation et les investissements en recherche axée sur le patient sont devenus hautement prioritaires aux États-Unis71, au Royaume-Uni72, en Europe (Allemagne, France, Scandinavie, Italie)73,74, et en Australie75,76. Conscients de l'importance de la recherche clinique pour leur santé nationale et leur compétitivité internationale, ces pays investissent massivement dans la reconstruction de leur entreprise de recherche clinique, pour mieux profiter des avantages sur le plan de la santé et des possibilités économiques qu'offre cet important secteur.
Les États-Unis
En 2002, l'initiative des National Institutes of Health (NIH) intitulée Roadmap faisait état de la nécessité de repenser la recherche clinique aux États-Unis. À l'exercice financier de 2007, le financement total dans le cadre de Roadmap s'élevait à 483 millions de dollars, puis est passé à 496 millions en 2008 et à 534 millions en 2009 (dans le cadre du budget global de 9 milliards consacré par les NIH aux essais cliniques et à d'autres types de recherche axée sur le patient). Outre le financement de Roadmap, les NIH ont investi 452,4 millions en 2009 dans le cadre de deux programmes administrés par le National Center for Research Resources : les General Clinical Research Centers et les Clinical and Translational Science Awards. Le programme des Science Awards aide les établissements d'enseignement à intégrer et à consolider leurs systèmes de façon à développer un bassin de chercheurs et d'équipes de recherche multidisciplinaires dûment formés, à créer un incubateur d'innovations en matière d'outils de recherche et de technologies de l'information et à stimuler la mise en pratique des nouvelles connaissances. Chaque centre reçoit 60 millions de dollars annuellement pour réaliser ce mandat.
La recherche clinique aux États-Unis a aussi profité d'investissements totalisant un milliard de dollars du Department of Veterans' Affairs et 330 millions de l'Agency for Healthcare Research and Quality, dont 79 millions sont réservés à la recherche sur la sécurité du patient. Cela s'ajoute à l'investissement de 1,1 milliard de dollars mentionné précédemment dans la recherche sur l'efficacité clinique dans le cadre de la Recovery Act de 2009. (Il est à noter que ces chiffres sont en dollars américains.) L'administration Obama reconnaît l'importance de la recherche pour la viabilité du système. Elle a récemment investi dans des évaluations comparatives comme moyen d'améliorer les soins et de limiter les coûts pour le système de santé américain, faisant valoir que les économies ainsi dégagées compenseront pour les coûts de la réforme de la santé77.
Le Royaume-Uni
Le Royaume-Uni a réalisé des progrès impressionnants en recherche axée sur le patient. Initialement, de vastes études comparatives ont été conçues pour le National Health Service (NHS) afin de guider les décisions en santé. Cette prémisse est en quelque sorte le fondement du mandat du UK National Institute for Health Research78, dont 53 % des investissements en recherche-développement sont consacrés à l'infrastructure d'étude clinique et de recherche sur les systèmes79.
En 2003, le Royaume-Uni a commencé à réorganiser son infrastructure de recherche clinique pour en améliorer l'efficacité et supprimer les barrières. Le NHS était alors divisé en 300 succursales fonctionnant de façon indépendante. Un tel morcellement rendait extrêmement difficiles les essais multicentriques. Les pouvoirs décisionnels reposaient sur divers intervenants, le système de recrutement était peu fiable et les processus de formation et la gestion des données devaient être uniformisés. Tout cela retardait les études et faisait grimper les coûts. À la lumière des recommandations de plusieurs rapports, dont Research for Patient Benefit80, et d'un examen du financement de la recherche en santé au Royaume-Uni81, le gouvernement a lancé deux initiatives nationales visant à surmonter ces obstacles : la UK Clinical Research Collaboration et, comme on l'appelle aujourd'hui, le réseau de recherche clinique du National Institute of Health Research (NIHR).
L'UK Clinical Research Collaboration est un partenariat entre le National Health Service, les bailleurs de fonds des secteurs public et privé de la recherche, l'industrie, les organismes de réglementation, les collèges royaux, les groupes de patients et le milieu universitaire. Ce partenariat vise à superviser la recherche axée sur le patient à l'échelle nationale. Quant au NIHR Clinical Research Network, il coordonne huit réseaux de recherche en Angleterre et travaille en étroite collaboration avec des programmes semblables en Écosse, au pays de Galles et en Irlande. Ensemble, ces réseaux couvrent six domaines thématiques (maladies neurodégénératives, santé mentale, ACV, cancer, diabète et pédiatrie), s'occupent de soins primaires et coordonnent des centres qui fournissent du soutien en profondeur aux six réseaux thématiques et au réseau sur les soins primaires.
Le Royaume-Uni a aussi procédé à l'élaboration de contrats de recherche communs pour les essais multicentriques, avec la participation de l'industrie pharmaceutique, pour faire en sorte que les priorités de recherche concordent avec les besoins de l'industrie.
Les Collaborations for Leadership in Applied Health Research and Care (CLAHRC) du NIHR ont été établies en 2008 en réponse à la nécessité pour le National Health Service de mettre davantage à contribution les capacités de l'enseignement supérieur dans les initiatives visant à augmenter l'efficience et l'efficacité des soins cliniques. Chacune des neuf collaborations entre une université et ses partenaires environnants du NHS recevra jusqu'à 10 millions de livres par année sur cinq ans, sans compter le financement de contrepartie, pour se concentrer sur le « deuxième vide » du processus d'application des connaissances, le passage de la recherche à la pratique.
Le Royaume-Uni y est allé d'une autre mesure audacieuse en créant le National Institute for Health and Clinical Excellence (NICE) en 1999. Le NICE a pour mission de promouvoir l'excellence clinique et l'utilisation optimale des ressources du système de santé. L'organisme se charge d'établir, de tenir à jour et de promouvoir des normes cliniques pour le système de santé du Royaume-Uni, de servir de guide et de tenir à jour une base de données nationale. Il a aussi ouvert la voie à une meilleure intégration des patients et des soignants, par exemple dans le choix des thèmes prioritaires pour la formulation des recommandations cliniques, la formulation des recommandations et, en tant que membres d'équipes de recherche, la planification, l'exécution et l'évaluation de la recherche soutenue par tous ses programmes de financement. Le Standing Advisory Group for Consumer Involvement in R&D (INVOLVE) se charge de créer des alliances entre des groupes clés pour optimiser la participation du public et habiliter les individus à jouer un rôle actif en recherche.
4.0 La stratégie
4.1 Vision
En 2025, le Canada aura amélioré de façon manifeste ses résultats cliniques et l'expérience thérapeutique des patients par l'intégration des données scientifiques à tous les niveaux du système de santé.
4.2 Objectifs
- Renforcer la capacité du Canada d'attirer, de former et d'encadrer des professionnels de la santé et des chercheurs en santé, et créer des cheminements professionnels viables en recherche axée sur le patient dans toutes les disciplines de la santé.
- Établir une infrastructure intégrée de recherche clinique de pointe pour le Canada, s'harmonisant avec tout le continuum de la recherche axée sur le patient.
- Rendre le cadre organisationnel, réglementaire et financier plus favorable aux études cliniques au Canada et faire participer davantage les patients et les cliniciens à ces études.
- Améliorer le processus de repérage des pratiques exemplaires, accélérer leur développement et leur adaptation sous forme de directives cliniques et soutenir leur adoption par les cliniciens, les soignants et les patients.
- Créer un processus pancanadien concerté pour la détermination, l'établissement et la mise en oeuvre des priorités de la recherche axée sur le patient.
4.3 Principes
La stratégie se fonde sur les principes qui suivent.
- Intérêt public – Faire en sorte que l'intérêt public soit d'une importance primordiale dans la création et l'utilisation des connaissances appuyées par les IRSC.
- Collaboration – Faire front commun avec les partenaires et les intervenants clés dans l'élaboration et la mise en oeuvre de la stratégie et dans la réalisation de ses objectifs.
- Réceptivité – S'assurer que les objectifs de recherche et d'application des connaissances soient guidés par les besoins désignés comme prioritaires.
- Excellence – Développer l'excellence dans les domaines où elle existe déjà et la promouvoir là où elle est absente.
- Inclusivité – Représenter la diversité des environnements cliniques, des professionnels et disciplines de la santé et des acteurs concernés au Canada.
- Innovation – Promouvoir une culture de constante remise en question et un engagement à faire place aux nouvelles idées et solutions.
- Responsabilisation – Appliquer les plus strictes normes éthiques et financières et les doter des critères de mesure et des processus d'évaluation nécessaires à l'estimation de l'impact de la stratégie et de l'atteinte de ses objectifs.
- Transparence – Prendre les décisions au grand jour et inclure les partenaires et les citoyens dans la discussion.
4.4 Combler les fossés entre la recherche et la pratique
Une série d'initiatives sont proposées pour combler les fossés entre la recherche et la pratique et positionner le Canada comme leader de la recherche axée sur le patient. Il s'agit moins d'éléments disparates que de parties d'un tout, où un élément prépare le terrain pour un autre et ainsi de suite, développant les capacités, les synergies et la confiance nécessaires à l'atteinte des objectifs de la stratégie.
Certaines des initiatives recommandées ont une portée plus étroite et sont susceptibles de rapporter rapidement des dividendes, compte tenu du degré de consensus existant sur la nature du problème, ainsi que du travail préparatoire déjà accompli (c'est-à-dire régler les questions entourant les examens de l'éthique et les modèles de contrats pour les essais multicentriques à grande échelle). D'autres, comme le développement d'une réserve de talents en recherche clinique, s'inscrivent dans le long terme. Cependant, il est essentiel de commencer dès maintenant, compte tenu de l'ampleur du défi, du besoin d'engager de nombreux partenaires et du temps dont nous disposons pour progresser. L'initiative des Réseaux de recherche axée sur le patient comporte des recommandations immédiates et à long terme. L'amélioration des processus de formulation et de diffusion des recommandations cliniques doit débuter sans tarder, par l'étude des facteurs influant sur la mise en pratique afin de pouvoir mettre en place les meilleures stratégies pour ce problème.
Chacune des initiatives recommandées comporte des idées pour réellement inclure les patients dans la recherche axée sur le patient, étant donné que la participation des patients et du public fait partie intégrante de la stratégie.
4.4.1 Établir un leadership commun
Pour que la stratégie permette d'obtenir des résultats, il est essentiel qu'elle soit guidée et dirigée par les deux ordres de gouvernement. Tous deux jouent un rôle dans chacun des éléments de la stratégie, dont les retombées économiques et les avantages pour le système de santé profiteront largement aux provinces. Même si des progrès peuvent être accomplis vers les objectifs de la stratégie sans l'engagement complet des gouvernements provinciaux et territoriaux, le genre de changement inclusif et transformateur qui est envisagé et nécessaire ne pourra se réaliser sans une gestion conjointe de la stratégie et sans un engagement et un leadership collectifs. Cela prendra sûrement du temps. Comme mesure préliminaire, une série de consultations sur ce document est prévue avec les gouvernements provinciaux et territoriaux.
Il existe également une occasion et une volonté d'agir rapidement dans certains domaines. Un groupe d'organismes gouvernementaux et non gouvernementaux et de champions nationaux des secteurs bénévole et privé se sont fermement engagés à faciliter les progrès de plusieurs éléments de la stratégie et à lui donner un élan. Les IRSC se sont montrés fortement engagés et prêts à jouer un rôle de leader, et plusieurs initiatives intéressantes sont déjà en cours.
La prochaine étape sera l'établissement d'un comité directeur national composé de représentants des gouvernements fédéral, provinciaux et territoriaux, des bailleurs de fonds de la recherche en santé, des chercheurs du secteur de la santé, des organismes d'information et d'évaluation en santé, des centres de santé universitaires, des industries et associations professionnelles concernées et des groupes de patients.
Il est proposé que le comité directeur soit présidé par le président des IRSC et coprésidé par quelqu'un de l'extérieur du gouvernement fédéral. Le comité directeur serait guidé par les principes de la stratégie, et ses membres seraient engagés à en réaliser la vision. Son secrétariat, hébergé dans les locaux des IRSC, serait dirigé par un directeur exécutif national. La majorité du travail du comité serait effectué dans le cadre de groupes de travail composés d'experts pourvus de mandats et d'obligations redditionnelles clairs et chargés de mettre à contribution leurs expertises et perspectives diverses.
Une des premières tâches du comité directeur sera de concevoir un plan de mise en oeuvre comprenant des délais concrets, des résultats à atteindre, des critères d'évaluation et une estimation des coûts des différents éléments de la stratégie. On pense aussi que le comité devrait s'occuper sans tarder de la création d'un processus national d'établissement des priorités de recherche axée sur le patient et des thèmes les plus importants pour l'amélioration de la santé des Canadiens. Il sera primordial d'inclure dans ce processus les directeurs scientifiques des IRSC ainsi que les organismes bénévoles en matière de santé, les organismes provinciaux de financement de la recherche en santé, ainsi que les patients et le public.
4.4.2 Constituer une réserve de talents
Pour prospérer, les cliniciens-chercheurs ont besoin d'un environnement qui les soutient33-38.
Tous les cliniciens-chercheurs, quelle que soit leur spécialité, sont essentiels à la recherche axée sur le patient, et il faut donc les soutenir davantage. Ils contribuent à la formation de la prochaine génération de chercheurs, mais ils ont besoin, eux aussi, de meilleures possibilités de formation et structures de soutien. Ils sont aussi essentiels pour poser les bonnes questions et savoir comment y répondre, mais ils ont souvent du mal à obtenir leur part des bourses de carrière dans le système de financement actuel. Ils contribuent aussi à l'application rapide des connaissances dans tout le continuum, de la découverte et de sa mise en application jusqu'à son intégration aux politiques. Le Canada a besoin de traitements basés sur des preuves scientifiques, et les cliniciens-chercheurs sont ceux qui peuvent fournir ces preuves. Même si certains réussissent à obtenir des bourses d'appui salarial dans des concours nationaux, leur nombre est tout simplement insuffisant. De plus, trop peu de cliniciens-chercheurs axent leur programme de recherche sur des questions liées aux soins et aux services de santé.
Ainsi, pour développer ses capacités de recherche axée sur le patient, le Canada doit refondre ses bourses de formation et d'appui salarial destinées aux cliniciens-chercheurs. Aussi attribuera-t-on les bourses de manière à :
- tenir compte des différentes stratégies ayant trait aux pratiques et à la rémunération (les plans de rémunération alternée, le paiement à l'acte pour les médecins, etc.), des différents types de postes (p. ex. les postes universitaires) et des sources d'aide financière destinées aux autres professionnels de la santé;
- tenir compte du milieu (p. ex. l'engagement de l'établissement d'accueil envers le candidat et son programme d'appartenance) et des réalisations de l'individu;
- voir plus loin que le soutien salarial et considérer les questions liées au recrutement des équipes de chercheurs, à l'élaboration des programmes ainsi qu'à l'infrastructure.
Les IRSC sont bien placés pour prendre les devants et jouer un rôle de leader dans ce domaine.
Le Canada doit aussi augmenter son contingent de spécialistes en méthodologie au service de la recherche axée sur le patient et de professionnels de la santé, surtout ceux qui détiennent un diplôme d'études supérieures et sont formés dans l'utilisation des principales méthodes de recherche. Cela obligera les universités de tout le pays à mieux soutenir les programmes de maîtrise et de doctorat dans des domaines comme l'épidémiologie et la biostatistique, l'économie de la santé et d'autres sciences sociales liées à la santé. Cela implique aussi la mise sur pied de programmes de formation normalisés pour les coordonnateurs et les gestionnaires de projets de recherche et pour les autres membres du personnel de soutien. Il sera essentiel de déterminer et de contacter les entités responsables de la formation du personnel de recherche afin d'aborder le cheminement professionnel complet de façon coordonnée. Les discussions sur la meilleure voie à suivre devront inclure non seulement les universités, mais peut-être aussi les ministères provinciaux de l'Éducation et les associations professionnelles.
L'octroi des bourses individuelles devrait être conditionnel à la contribution des départements cliniques ou universitaires, d'hôpitaux, d'universités et d'autorités sanitaires locales ou régionales, selon le cas. De plus, les boursiers devront faire l'objet d'un suivi périodique quant à leur rendement et à l'engagement de leur établissement à leur égard.
4.4.3 Améliorer la conduite, le financement et l'efficacité des essais cliniques multicentriques
Il est plus facile de gérer de grandes études cliniques avec des politiques et procédures normalisées et des modèles de contrat qui, dans la mesure du possible, intègrent les pratiques reconnues internationalement tout en répondant aux besoins particuliers du Canada. Il existe une occasion de procéder rapidement pour éliminer les obstacles particuliers à la conduite de vastes ECR au Canada. Les progrès réalisés dans les ECR pourraient ensuite être adaptés en fonction des besoins d'autres types d'études cliniques.
En matière d'éthique, l'expérience et les progrès récents du Royaume-Uni, de l'Australie et de la France, qui ont harmonisé leurs examens éthiques, sont des exemples intéressants pour le Canada. De plus, la Colombie-Britannique, l'Alberta, le Québec, Terre-Neuve-et-Labrador et Action Cancer Ontario ont conçu des modèles d'examen uniques, ou sont en voie de migrer vers un modèle unique, ce qui fournit une base solide pour aller de l'avant.
En matière de contrats normalisés, le but est de créer des modèles pouvant être approuvés par chaque province et territoire sachant que, une fois produits, ils devront être adaptés à la réglementation locale. Encore une fois, il est possible de s'inspirer de modèles et d'expériences récentes. Un modèle d'entente d'essai clinique a été adopté au niveau national au Royaume-Uni par tous les intervenants concernés. D'autres pays, comme l'Australie, les États-Unis et l'Allemagne, en sont à différentes étapes de la préparation de telles ententes, mais aucune n'a encore été pleinement approuvée. Au Canada, des progrès ont été réalisés dans certaines provinces. Des guides de négociation des ententes d'essai clinique ont été produits en Ontario avec l'aide de l'Ontario Institute for Cancer Research. Au Québec, un projet d'entente d'essai clinique conçu au ministère de la Santé fait l'objet de discussions, et certains progrès ont été réalisés en Alberta par le Northern Alberta Clinical Trials Research Centre. À l'heure actuelle, un intérêt a été exprimé à la fois par l'industrie pharmaceutique canadienne et les organismes universitaires de soins de santé pour la production d'un modèle d'entente d'essai clinique canadien, qui serait destiné à l'usage des bailleurs de fonds de l'industrie et des centres de santé universitaires, en particulier dans les essais cliniques multicentriques.
Une fois créés, les réseaux de recherche axée sur le patient proposés et les unités de soutien abordées plus loin peuvent servir de véhicule de diffusion de ces ententes normalisées et peuvent contribuer à garantir que toutes les interventions visant à améliorer la rapidité et l'efficacité soient accompagnées de critères de mesure, soient évaluées et fassent l'objet de rapports, afin que les objectifs soient atteints.
Actuellement, nous manquons de fonds pour financer les essais cliniques dont nous aurions grandement besoin pour répondre aux nombreuses questions des Canadiens liées aux soins de santé. L'établissement de priorités axées sur les besoins, avec la participation claire des patients, pourrait aussi faciliter l'obtention de fonds publics auprès de sources telles que les différents ordres de gouvernement, les organismes bénévoles en matière de santé et les fondations. En particulier, notre pays doit accroître ses investissements dans les essais cliniques s'il veut regagner le terrain perdu et se positionner comme leader mondial de la recherche axée sur le patient. Les partenariats dans le milieu universitaire, l'industrie et le secteur bénévole sont essentiels pour fournir plus de moyens à la recherche axée sur le patient au Canada.
Les succès dans l'établissement d'ententes sur l'examen éthique et la normalisation des contrats devraient entraîner une hausse des investissements privés dans les grands projets multicentriques, qui requièrent souvent toute une mosaïque de commanditaires. Cela sera particulièrement le cas si les principaux partenaires financiers participent à la création des modèles et des ententes normalisés. Le fait de parvenir à un accord sur ces questions contribuera aussi à l'avantage concurrentiel du Canada en rendant notre pays plus attrayant pour les sociétés étrangères désireuses d'effectuer des essais cliniques et d'autres grandes études cliniques de façon efficace, à moindre coût et sans perte de temps.
4.4.4 Se concentrer sur les réseaux de recherche axée sur le patient
Réseaux de recherche axée sur le patient
Comme nous l'avons vu, le milieu canadien de la recherche axée sur le patient possède déjà une expérience de collaboration impressionnante dans le cadre de réseaux multidisciplinaires ou d'équipes d'experts. Cependant, nous avons besoin de stratégies pour assurer la viabilité de leurs réseaux, les relier les uns aux autres et leur fournir le soutien méthodologique nécessaire à l'atteinte de leurs objectifs de recherche.
Dans le cadre de la stratégie, les directeurs scientifiques des IRSC et les représentants des divers acteurs et partenaires financiers établiront les thèmes de recherche clinique prioritaires pour la création de réseaux de recherche axée sur le patient. Ces réseaux auront pour rôle d'établir les priorités de recherche et de formuler des protocoles cliniques, de contribuer à la supervision scientifique des programmes de recherche, de soutenir les scientifiques par diverses activités d'enseignement et de mentorat, et de stimuler la recherche interdisciplinaire. Ils exerceront le leadership scientifique nécessaire à la direction des projets de recherche les plus pertinents pour les Canadiens. Ils participeront au recrutement des patients pour les grandes études multicentriques et superviseront le déroulement de ces dernières. Centrés sur les solutions, ils relieront les chercheurs ou les centres d'excellence actuels et nouveaux de tout le pays aux fins de la recherche axée sur le patient dans les secteurs désignés. Ils privilégieront la recherche axée sur les résultats et répondant aux besoins des différents intervenants et utilisateurs de la recherche : les cliniciens, l'industrie, les responsables des politiques, les patients et le public. Ils devront démontrer leur accès aux spécialistes en méthodologie et au personnel de recherche nécessaires et soumettre un plan de développement des capacités dans ces catégories. Chaque réseau devra démontrer comment le soutien du projet sera assuré (p. ex. la gestion de projet, l'aide méthodologique et les services de gestion de données et de statistiques).
Pour atteindre ces objectifs, chaque réseau de recherche axée sur le patient disposera des ressources pour faire en sorte que les dirigeants aient du temps réservé, un soutien administratif et des fonds suffisants. Les réseaux devront :
- constituer une masse critique d'expertise scientifique multidisciplinaire;
- établir des liens avec d'autres chercheurs de leur domaine au moyen de réunions et de communications régulières;
- établir un programme national et concerté de recherche axée sur le patient;
- mettre au point un processus coordonné de financement auprès des bailleurs de fonds concernés;
- intégrer les unités de soutien (voir ci-dessous) qui mettront en commun leur expertise en méthodologie, en biostatistique et en gestion de projet;
- participer activement à la recherche universitaire et aider à en disséminer les résultats auprès de tous les intervenants des soins de santé;
- encadrer leurs chercheurs émergents par l'enseignement et le mentorat;
- coordonner l'ensemble des activités de recherche propres aux projets de manière à bien soutenir les chercheurs dans leur domaine d'expertise;
- optimiser l'efficience du recrutement des patients pour les essais à grande échelle;
- veiller à ce que chaque étude à grande échelle se conforme aux normes éthiques les plus rigoureuses et aux normes de fonctionnement nationales.
Le Réseau sur l'innocuité et l'efficacité des médicaments (RIEM), un complément de la présente stratégie, est un exemple de réseau de recherche axée sur le patient créé autour d'un thème particulier, considéré comme prioritaire par les gouvernements fédéral et provinciaux (la sécurité des consommateurs). Conçu principalement pour la recherche par observation, en particulier les études pharmaco-épidémiologiques, il pourrait aussi recourir aux essais cliniques pour accomplir sa mission. Même si le RIEM est antérieur à la présente stratégie, il s'agit d'un excellent exemple de réseau de recherche thématique.
On prévoit que les secteurs public et bénévole seront grandement intéressés à faire équipe avec les réseaux, étant donné que ceux-ci seront centrés sur des thèmes correspondant au mandat de nombreux organismes bénévoles.
4.4.5 Établir des unités de soutien
Unités de recherche axée sur le patient
Un autre élément de la stratégie sera la création de centres de services de recherche spécialisés, ou unités de soutien à la recherche axée sur le patient, afin de mettre à la disposition des chercheurs l'expertise méthodologique souvent très spécialisée dont ils ont besoin.
Ces unités de soutien sont des centres multidisciplinaires composés d'experts en méthodologie et dans d'autres domaines essentiels à la recherche axée sur le patient : épidémiologistes cliniques, biostatisticiens, spécialistes en sciences sociales, économistes de la santé, experts en essais cliniques, etc. Elles comprendront aussi du personnel de soutien de la recherche, notamment des coordonnateurs de la recherche, des associés et des adjoints de recherche et des collecteurs et des analystes de données. Leur rôle sera d'aider les chercheurs à concevoir des études pertinentes (tant observationnelles qu'interventionnelles), de faire des analyses biostatistiques, de gérer les données et les biobanques, de fournir et de transmettre l'expertise en gestion de projet et d'assurer la conformité des études à la réglementation et aux normes applicables.
Il y aura deux types d'unités de soutien.
1. Les unités géographiques, qui seront axées sur le développement du soutien méthodologique lorsqu'il est inexistant ou lorsque les ressources sont inadéquates pour soutenir la recherche en cours ou envisagée dans un endroit en particulier. À l'aide d'un modèle d'application des connaissances intégrée, elles formeront plus de gens et seront directement engagées dans la prise de décisions scientifiques au niveau local.
Ces unités de soutien viseraient trois objectifs :
- fournir un soutien méthodologique et logistique aux chercheurs cliniques locaux pour améliorer la qualité de leurs propositions et travaux de recherche et rehausser leur compétitivité dans le cadre des concours de subventions de recherche;
- développer les capacités en méthodologie et en soutien à la recherche en offrant de la formation et de l'expérience dans ces disciplines;
- soutenir les cliniciens, les gestionnaires et les administrateurs dans la prise de décisions et l'application de pratiques exemplaires dans le contexte clinique et dans les circonscriptions hospitalières, en travaillant en partenariat pour répondre aux besoins en recherche et en pratiques exemplaires cernés par le secteur clinique.
Les directeurs d'hôpitaux, les autorités sanitaires régionales et les administrateurs locaux devront démontrer leur engagement à l'égard des unités de soutien en fournissant l'espace et les fonds de contrepartie nécessaires et en établissant un plan pour assurer leur viabilité. Ils devront aussi montrer comment ils interagiront avec les unités pour promouvoir la recherche sur les questions liées aux soins et aux services de santé au niveau local (et stimuler l'adoption des pratiques exemplaires).
2. Les unités de portée plus nationale, qui fourniront un soutien dans l'utilisation de méthodes plus spécialisées ou un soutien méthodologique dans certaines disciplines liées aux soins de santé autres que la médecine, comme les sciences infirmières, la réadaptation, la dentisterie et d'autres, pour aider les chercheurs à parfaire leurs compétences en recherche et à effectuer de meilleures recherches.
Les unités de soutien de ce type seront encouragées à développer des créneaux d'excellence dans des domaines comme les essais contrôlés randomisés, les études par observation avec bases de données administratives, les examens systématiques, la science de l'application des connaissances et la formulation de recommandations, ce qui rehaussera leur compétitivité internationale. Ces unités pourront aussi être de nature plus virtuelle et servir de ressource méthodologique pour soutenir la recherche en sciences infirmières, en réadaptation ou autres, ce qui encouragera les chercheurs, en sciences infirmières par exemple, à partager cette ressource pour améliorer la qualité et la compétitivité de la recherche en sciences infirmières.
4.4.6 Améliorer la formulation, la diffusion et la mise en pratique des lignes directrices
Le Canada a besoin d'une approche concertée assortie de ressources suffisantes pour s'assurer que les lignes directrices cliniques soient rigoureusement formulées à partir de preuves scientifiques et mises en pratique efficacement, de façon à améliorer la qualité des soins et les résultats en santé. Les paragraphes qui suivent exposent les éléments recommandés de cette approche.
-
Concevoir et offrir des cours et des modules de formation aux responsables des lignes directrices. Des modules de formation bien conçus faciliteraient le travail des responsables des lignes directrices et leur permettraient de mieux coordonner leurs efforts, en plus de promouvoir la rigueur dans la formulation des recommandations à partir de preuves scientifiques. La formation servirait aussi à intégrer au processus de formulation un souci d'harmonisation avec les autres recommandations pertinentes. Les responsables devraient aussi collaborer à des tâches pour accélérer la production des lignes directrices.
-
Soutenir la formulation des lignes directrices. La formulation de recommandations à partir de preuves scientifiques est un processus coûteux : on estime qu'il en coûte entre 100 000 et 1 million de dollars pour produire une seule série de lignes directrices. Il est proposé que les gouvernements fédéral et provinciaux offrent du financement de contrepartie aux responsables des lignes directrices qui répondent à certains critères en matière de rigueur dans le processus de formulation et de contenu.
-
Inclure les patients dans le processus de formulation des lignes directrices. Il est important que les patients et les soignants participent davantage au processus de formulation des lignes directrices, à partir de l'établissement des priorités jusqu'au travail de formulation comme tel, non seulement pour la qualité des lignes directrices, mais aussi pour leur mise en pratique future. Le Canada peut tirer des leçons importantes de l'initiative NICE du Royaume-Uni, décrite plus haut, pour élaborer une stratégie dans ce domaine.
-
Accroître les capacités de synthèse de connaissances. Même si le Canada possède une excellente réputation internationale et fait du très bon travail dans ce domaine, il est nécessaire d'en développer les capacités. Pour commencer, les IRSC devraient augmenter leurs investissements dans le Centre Cochrane et explorer les possibilités de partenariat entre le Réseau-centre canadien Cochrane et d'autres organismes canadiens participant à la synthèse de connaissances, notamment la FCRSS et l'ACMTS.
-
Élaborer une stratégie complète d'application des connaissances (AC). Les stratégies actuelles de diffusion des lignes directrices - publication dans des revues scientifiques, intégration aux programmes de perfectionnement professionnel continu, colloques et séminaires - se sont avérées peu efficaces pour modifier les pratiques professionnelles82, 83. La mise en pratique viable des lignes directrices est un travail difficile et complexe. Plusieurs études ont démontré que les taux d'adhésion diminuent souvent au terme des stratégies de mise en pratique84. Malheureusement, les données indiquent que les activités de diffusion et de mise en pratique de recommandations au Canada ont diminué entre 1994 et 2005, ce qui veut dire que des patients sont probablement privés d'effets potentiels notables pour leur santé61.
Activités recommandées
-
Financer davantage de recherches sur les obstacles à la mise en pratique et de stratégies pour accélérer la mise en pratique. Nous avons besoin de réaliser beaucoup plus de recherches pour mieux comprendre les barrières systémiques, organisationnelles et individuelles à la mise en pratique des recommandations cliniques par le système de santé, les cliniciens et les patients, et pour mieux connaître les meilleures stratégies de diffusion et de mise en pratique.
-
Adapter l'organisation des soins. La mise en pratique des lignes directrices est souvent infructueuse à moins que l'organisation des soins ne soit modifiée ou repensée pour faciliter le recours par le personnel clinique à des pratiques exemplaires fondées sur des preuves scientifiques. Les systèmes de santé provinciaux et territoriaux devront s'engager à trouver des moyens de favoriser la mise en application des pratiques et des politiques fondées sur des preuves scientifiques.
5.0 Conclusion
En 2025, le Canada aura amélioré de façon manifeste ses résultats en matière de santé et l'expérience thérapeutique des patients par l'intégration des preuves scientifiques à tous les niveaux du système de santé. Il s'agit de la vision qui oriente l'élaboration de la Stratégie de recherche axée sur le patient du Canada.
Pour les patients, l'avantage prévu de la « recherche axée sur le patient » sera d'obtenir les bons soins, au bon endroit et au bon moment. Pour ce faire, il faut que les professionnels et les décideurs de la santé aient accès aux preuves scientifiques les plus récentes, ce qui requiert le transfert rapide et efficace des innovations scientifiques du laboratoire au chevet du patient, ainsi que l'évaluation et la synthèse des connaissances existantes et leur transmission au personnel clinique. Pour les gouvernements et les administrateurs de la santé provinciaux, l'avantage sera de posséder des systèmes de santé efficaces et économiques qui répondent aux besoins des patients et améliorent la santé des Canadiens de façon constante. Pour le gouvernement du Canada, l'avantage sera d'atteindre un certain nombre d'objectifs clés de la stratégie des sciences et de la technologie, notamment de stimuler la commercialisation de la recherche.
Les gouvernements, l'industrie et le secteur bénévole de la santé devront travailler avec le comité directeur national pour faire progresser la recherche axée sur le patient en trouvant des solutions au problème du sous-financement et en gérant la complexité de la conception et de la mise en oeuvre d'un programme.
Le Canada fait des progrès en matière de recherche axée sur le patient, mais ces progrès sont lents et souvent dispersés et entravés par des barrières fédérales-provinciales, interdisciplinaires et structurelles. La réalité économique des provinces et des territoires, les défis de santé persistants et émergents et la croissance des attentes des fournisseurs et des patients rendent nécessaire une stratégie de recherche axée sur le patient, à la fois ambitieuse et innovatrice, qui établit une orientation claire et commune et permettra de combler les vides dans le continuum recherche-pratique et de transformer le paysage des soins de santé au Canada. C'est cette orientation que cherche à favoriser la présente stratégie, au coeur de laquelle se trouvent les patients et le public.
Bref, les besoins sont grands, les retombées potentielles sont immenses, et le Canada est prêt.
6.0 Bibliographie
-
Evidence-Based Medicine Working Group. Evidence-Based Medicine: A New Approach to Teaching the Practice of Medicine. JAMC. 1992; 268(17):2420-2425.
-
Ferriman A. BMJ readers choose the "sanitary revolution" as greatest medical advance since 1840. BMJ. 18 janv. 2007; 334:111.
-
Haynes AB, Weiser TG, Berry WR, Lipsitz SR, Breizat AS, Dellinger EP et coll. A surgical safety checklist to reduce morbidity and mortality in a global population. N Engl J Med. 24 mars 2009; 360 (5):491-499.
-
Albani S, Prakken B. The advancement of translational medicine – from regional challenges to global solutions. Nature Medicine. Septembre 2009; 15(9):1006-1009.
-
Fang FC, Casadevall A. Lost in translation – basic science in the era of translational research. Infection and Immunity. Fév. 2009; 78(2):563-566.
-
Wennberg JE, Gittelsohn A. Small area variations in health care delivery. Science. 14 déc. 1973; 182:1102-1108.
-
Wennberg JE. Dealing with medical practice variations: A proposal for action. Health Aff. Été 1984; 3(2):6-32.
-
Wennberg JE, Elliott SF, Skinner JS. Geography and the debate over Medicare. Heath Aff. 13 fév. 2002; W97-W114.
-
Fisher ES, Wennberf DE, Stukel TA, Gottlieb DJ, Lucas FL, Pinder EL. The implications of regional variations in Medicare spending. Part 1. The content, quality, and accessibility of care. Ann of Intern Med. 2003; 138:273-287.
-
Wennberg DE, Wennberg JE. Addressing variations: Is there hope for the future? Health Aff. 10 déc. 2003; W3:614-617.
-
Weinstein JN, Bronner KK, Morgan TS, Wennberg JE. Trends: Trends and geographic variation in major surgery for degenerative diseases of the hip, knee, and spine. Health Aff. Web Exclusive. 7 oct. 2004: Var81-Var89.
-
Straus SE, Ball C, Balcombe N, Sheldon J, McAlister FA. Teaching evidence-based medicine skills can change practice in a community hospital. JGIM. Avril 2005; 20(4):340-343.
-
Lloyd K, Cella M, Tanenblatt M, Coden A. Analysis of clinical uncertainties by health care professionals and patients: an example from mental health. West J Med. Mai 2000; 172(5):315-319.
-
Kiesler DJ, Auerbach SM. Optimal matches of patient preferences for information, decision-making and interpersonal behaviour: Evidence, models and interventions. Patient Educ Couns. 2006; 61:319-341.
-
McGlynn EA et coll. The quality of health care delivered to adults in the United States. New Engl J Med 2003; 348(26):2635-2645.
-
DuBois A, Rochon J, Lamparter C, Pfisterer J. Pattern of care and impact of participation in clinical studies on the outcome in ovarian cancer. Int J Gynecol Cancer. 2005; 15:183-191.
-
Majumber SR, Roe MT, Peterson ED, Chen AY, Gibler WB, Armstrong PW. Better outcomes for patients treated at hospitals that participate in clinical trials. Arch Intern Med. 2008; 168(6):657-662.
-
Weinsaft JW, O'Rourke MF, Nichols WW, Sharma AM, Pischon T, Engeli S et coll. Effect of Ramipril on cardiovascular events in high-risk patients. N Engl J Med. 2000; 343:64-66, 6 juil. 2000.
-
Fergusson D, Glass KC, Hutton B, Shapiro S. Randomized controlled trials of aprotinin in cardiac surgery: could clinical equipoise have stopped the bleeding? Clinical Trials. 2005; 2:218-232.
-
Hébert PC. Transfusion requirements in critical care. Vox Sang. Août 2002; 83 Suppl 1:387-396.
-
Kwan J, Sandercock PAG. In-hospital care pathways for stroke. Cochrane Database Systc Rev. 2004; 4. Art. No.: CD002924. DOI: 10.1002/14651858.CD002924.pub2.
-
Bailey RC, Moses S, Parker CB, Agot K, Maclean I, Krieger JN, Williams CF, Campbell RT, Ndinya-Achola JO. Male circumcision for HIV prevention in young men in Kisumu, Kenya: a randomised controlled trial. Lancet. 24 fév. 2007; 369(9562):643-656.
-
Murphy KE, Hannah ME, Willan AR, Hewson SA, Ohlsson A, Kelly EN et coll. Multiple courses of antenatal corticosteroids for preterm birth (MACS): a randomised controlled trial. Lancet. Déc. 2008 20/27;372:2143-2151.
-
Stevens B, Yamada J, Ohlsson A. The efficacy of sucrose to reduce procedural pain in neonates as assessed by physiologic and behavioural outcomes. Neonatal Modules of the Cochrane Database of Systematic Reviews. The Cochrane Collaboration. Eds. Sinclair JC, Brachen MB, Soll RS. Update Software, Oxford. 2002.
-
Pisters KM, Evans WK, Azzoli CG, Kris MG, Smith CA, Desch CE et coll. Cancer Care Ontario and American Society of clinical Oncology adjuvant chemotherapy and adjuvant radiation therapy for stages I-IIIA resectable non small-cell lung cancer guideline. J Clin Oncol. 1er déc. 2007; 25(34):5506-5518.
-
Ellard SL, Clemons M, Gelmon KA, Norris B, Kennecke H, Chia S et coll. Randomized Phase II study comparing two schedules of Everolimus in patients with recurrent/metastatic breast Cancer: NCIC Clinical Trials Group IND.163. JCO. 20 sept. 2009:4536-4541.
-
Anis A, Nosyk B, Sun H, Guf DP, Banasback N, Li X, et coll. Quality of life of patients with advanced HIV/AIDS: measuring the impact of both AIDS-defining events and non-AIDS serious adverse events. J Acquir Immune Defic Syndr. Août 2009; 51(5):631-639.
-
Douketis J, Cook D, Meade M, Guyatt G, Geerts W, Skrobik Y et coll. Prophylaxis against deep vein thrombosis in critically ill patients with severe renal insufficiency with the low-molecular-weight heparin dalteparin: an assessment of safety and pharmacodynamics: the DIRECT study. Arch Intern Med 8 sept. 2008; 168(16):1805-1812.
-
Chalmers I, Glasziou P. Avoidable waste in the production and reporting of research evidence. Lancet. 4 juillet 2009; 374:86-89.
-
Picard A. Real patient care reform could be a mouse-click away (en anglais seulement). The Globe and Mail. 11 nov. 2010.
-
Nason E, Brisbois R. Clinical research networks in Canada: an environmental scan. Réseaux canadiens de recherche en politiques publiques, Ottawa. 2009.
-
Lawlor MS. Biotechnology and Government Funding: Economic Motivation and Policy Models. Science and Cents: Exploring the Economics of Biotechnology Conference. (Ed. JV Duka and MK Yücel). Federal Reserve Bank of Dallas. 2002 April 19; 132-146.
-
Frontera WR, Fuhrer MJ, Jette AM, Chan L, Cooper RA, Duncan PW et coll. Rehabilitation medicine summit: building research capacity. Executive Summary. J Neuroeng Rehabil [série dans Internet] (en anglais seulement). 2006 [cité le 12 déc. 2008] 3:1.
-
DeHaven MJ, Wilson GR, O'Connor-Kettlestrings, P. Creating a research culture: What we can learn from residencies that are successful in research. Educational Research and Methods.1998; 30(7):501-507.
-
Kekki P. Promoting clinical research in general practice. Educ Health (Abingdon). 2005; 18(2):283-289.
-
Cooke J. A framework to evaluate research capacity building in health care. BMC Family Practice [série en ligne]. 2005 [cité le 12 déc. 2008] 6:44.
-
Vratny A, Shriver D. A conceptual model for growing evidence-based practice. Nurs Adm Q. 2007; 31(2):162-170.
-
Araki Y, Scott SE, Lear S. Challenges of telehealth research in clinical settings. J Telemed Telecare. 2007; 13:425-426.
-
Collet JP, Fraser W, Johnston C, Lacroix J, Paradis G, Valiquette L et coll. Rapport sur la recherche clinique. Document présenté au conseil d'administration du Fonds de la recherche en santé du Québec. 11 mars 2005.
-
Brimacombe GG, Gruenwoldt EC. Progresser au rythme de la découverte. Des laboratoires au chevet du patient au marché. 2007.
-
Prud'homme Généreux A, Cairns J. Summary report: CIHR/CFI Atelier sur les centres/réseaux de recherche clinique. Instituts de recherche en santé du Canada, 21 janvier 2005.
-
Rouleau J. Clinical research in Canada: A proposed action plan. 2008.
-
Silverman M. A roadmap to ensure Canadian leadership in clinical and translational research. Initiative de recherche clinique des Instituts de recherche en santé du Canada. 2004.
-
Syntegrity Group. Instituts de recherche en santé du Canada: Clinical research syntegration – Juillet 2008. Version 1.0.
-
Sondage national des médecins. 2007 Sondage national des médecins.
-
SHI Consulting. Clinical trial coordinating centre business case. Report for the CT CTNet Working Group. 2008.
-
Conseil d'examen du prix des médicaments brevetés. Rapport annuel 2007.
-
IMD. World competitiveness yearbook, 2005. 2005.
-
Thiers FA, Sinskey AJ, Berndt ER. Trends in the globalization of clinical trials. Nature Reviews Drug Discovery 7, 13-14 (janvier 2008) doi:10.1038/nrd2441 News Analysis.
-
Wu T, Youping L, Zhaoxiang B, Liu G, Moher D. Randomized trials published in some Chinese journals: How many are randomized? Trials. 2009; 10:46.
-
Tharyan P, Premkumar TS, Mathew V, Barnabas JP, Raj M. Editorial policy and the reporting of randomized controlled trials: A survey of instructions for authors and assessment of trial reports in Indian medical journals (2004-05). Natl MedJ I. 2008; 21(2):62-68.
-
Zhang D, Yin P, Freemantle N, Jordan R, Zhong N, Cheng KK. An assessment of the quality of randomized controlled trials conducted in China. Trials. 24 avril 2008; 9:22.
-
El Emam K, Jonker E, Sampson M, Krleza-Jerić K, Neisa A. The use of electronic data capture tools in clinical trials: Web-survey of 259 Canadian trials. J Med Internet Res. 9 mars 2009; 11(1):e8.
-
Woodbury MG. Research 101: Developing critical evaluation skills. Wound Care Canada. 2003; 2(2):32-38.
-
Moldofsky M, Arts K, Evans L. Harmonization of clinical trial agreements. Conférence nationale de l'ACARU. 7 mai 2007.
-
Woolf SH. Practice guidelines, a new reality in medicine. II. Methods of developing guidelines. Arch Intern Med. Mai 1992; 152(5):946-952.
-
Davis D, Goldman J, Palda VA. Handbook on clinical practice guidelines. Association médicale canadienne 2007. Ottawa.
-
Grimshaw JM, Thomas RE, MacLennan G, Fraser C, Ramsay CR, Vale L et coll. Effectiveness and efficiency of guideline dissemination and implementation strategies. Intl J of Technology Assessment in Healthcare. 2005; 21(1):149.
-
Agence canadienne des médicaments et des technologies de la santé. Optimal Therapy Report. COMPUS, 2009; 3(4).
-
Graham ID, Beardall S, Carter AO, Glennie J, Hébert PC, Tetroe JM et coll. What is the quality of drug therapy clinical practice guidelines in Canada? JAMC. 2001;165(2):157-163.
-
Kryworuchko J, Stacey D, Bai N, Graham ID. Twelve years of clinical practice guideline development, dissemination and evaluation in Canada (1994 to 2005) (en anglais seulement). Kryworuchko J, Stacey D, Bai N, Graham ID. Implement Sci. 5 août 2009;4:49.
-
Davis DA, Taylor-Vaisey A. Translating guidelines into practice: A systematic review of theoretic concepts, practical experience and research evidence in the adoption of clinical practice guidelines. Journal de l'Ass. méd. can. 15 août 1997; 157(4):408-416, AMC, 1997.
-
Oliver S, Armes DG, Gyte G. Public involvement in setting a national research agenda: a mixed methods evaluation. Juillet 2009; 2(3):179-190.
-
Chalmers I. The perinatal research agenda: whose priorities? Birth. 1991;18:137-145.
-
Chalmers I. What do I want from health research and researchers when I am a patient? BMJ. 1995; 310:1315-1318.
-
Oliver S. How can health service users contribute to the NHS research and development programme? BMJ. 1995; 310:1318-1320.
-
Sleep J, Grant A, Garcia J et coll. West Berkshire perineal management trial. Br Med J (Clin Res Ed). 1984; 289(6445):587.
-
Thornton H. Patient and public involvement in clinical trials. BMJ. 24 avril 2008; 336(7650):903-904.
-
Fish, EN. The X-files in immunity: sex-based differences predispose immune responses. Nature Reviews Immunology. Sept. 2008; 8:737-744.
-
Berlin JA, Ellenberg SS. Women in clinical trials (en anglais seulement). BMC Medicine. 2009, 7:56.
-
National Center for Research Resources. Strategic plan 2009-2013 (en anglais seulement). NIH Publication No. 08-6439. National Center for Research Resources, National Institutes of Health. 2008.
-
United Kingdom Clinical Research Collaboration. UK Clinical Research Collaboration progress report (en anglais seulement), 2006-2008. 2008 (United Kingdom).
-
European Strategy Forum on Research Infrastructures. European Roadmap for Research Infrastructures: Roadmap 2006 (en anglais seulement). Luxembourg: Office for Official Publications of the European Communities. 2006.
-
European Strategy Forum on Research Infrastructures. European roadmap for research infrastructures: Roadmap 2008 (en anglais seulement). Luxembourg: Office for Official Publications of the European Communities. 2008.
-
Department of Innovation, Industry, Science and Research, Australian Government. Strategic roadmap for Australian research infrastructure. 2008 (en anglais seulement).
-
National Health and Medical Research Council. Clinical research in Australia. Report of the NHMRC Clinical Research Working Group (en anglais seulement). 2001 (Australia).
-
McKinnon JD, Bendavid N. Congress is buying time for health care savings (en anglais seulement). The Wall Street Journal. 28 mars 2009.
-
National Institute for Health Research. Best research for best health (en anglais seulement). 2007.
-
National Health Service. Delivering health research. National Institute of Health Research progress report 2008-09 (en anglais seulement).
-
Research for Patient Benefit Working Party. Final Report (en anglais seulement). Department of Health, United Kingdom. 2004.
-
Cooksey D. A review of UK health research funding. (en anglais seulement) 2006 (United Kingdom).
-
Grimshaw JM, Thomas RE, MacLennan G, Fraser C, Ramsay CR, Vale L et coll. Effectiveness and efficiency of guideline dissemination and implementation strategies. Health Technol Assess. 2004; 8:1-84.
-
Grimshaw J, Eccles M, Thomas R, MacLennan G, Ramsay C, Fraser C, Vale L. Toward evidence-based quality improvement. Evidence (and its limitations) of the effectiveness of guideline dissemination and implementation strategies 1966-1998. J Gen Intern Med. 2006; 21:14-29.
-
Bauer MS. A review of quantitative studies of adherence to mental health clinical practice guidelines: Harvard Rev of Psych. Mai 2002; 10(3):138-153.
7.0 Annexe 1 : Membre du conseil consultatif du président – Stratégie de recherche axée sur le patient
Titre lorsque membre du conseil
Dr Aubrey Tingle
Ancien dirigeant de la Fondation Michael Smith
Dr Arthur Slutsky
Vice-président à la recherche
Hôpital St. Michael's
Dre Catriona McMahon
Vice-présidente, Affaires médicales
AstraZeneca Canada inc.
Dr Jean L. Rouleau
Doyen, Faculté de médecine
Université de Montréal
Madame Sally Brown
Directrice exécutive
Fondation des maladies du coeur du Canada
Madame Krista Connell
Chef de la direction
Nova Scotia Health Research Foundation
Dr Roger Palmer
Doyen intérimaire, École de santé publique
Université de l'Alberta
Dr Brian Postl
Chef de la direction
Office régional de la santé de Winnipeg
Madame Susan Zimmerman
Directrice exécutive
Secrétariat en éthique de la recherche
Professeure Dorothy (Dot) Pringle
Faculté des sciences infirmières
Université de Toronto
Dre Sarah Prichard
Vice-présidente, Affaires médicales internationales
Baxter International inc.
- Date de modification :